高校の化学で、酸化数という概念とその計算方法について学習しますが、酸化数の意味や原理については学習していないかと思います。
本記事では、そもそも酸化数とは何なのか、なぜアルカリ金属の酸化数は+1にするか、と言った根本的なことについて解説します。
なお、本サイトは大学化学について扱っていますが、本記事については高校生でも理解できます。ぜひご覧ください。
酸化数とは
酸化数は、分子中の各原子がもつ仮想的な電荷を表現したものです。
例えば、塩化ナトリウムNaClはイオン性の分子で、Na+とCl−から構成されているため、NaClにおけるNaの酸化数は+1、Cl−の酸化数は−1となります。
では、アンモニアNH3はどうでしょうか。アンモニアは共有結合性の分子なので、先ほど説明したNaClのように単純に考えることはできません。
しかし、各原子は電子を引き付ける能力に差があるため、イオン結合ほどではありませんが、多かれ少なかれ電子の位置に偏りが生じます。
アンモニアの場合、電気陰性度はH<Nのため、NはHに比べて負に帯電していると考えることができます。ここで、大胆ではありますが、アンモニアがイオン性の分子であると無理やり考えると、3つのH+と1つのN3−のイオン結合から構成されていると考えられるため、Hの酸化数を+1、Nの酸化数を−3であるとします。
このように、酸化数は「イオン結合性と考えて無理やり割り当てた電荷」ともいえます。
なお、IUPACは酸化数(Oxydation state; OS)を次のように定義しています。
OS of an atom is the charge of this atom after ionic approximation of its heteronuclear bonds.
IUPAC Gold Book < https://doi.org/10.1351/goldbook.O04365 >
酸化数の計算ルールなど必要ない
高校の化学では次に示す酸化数の計算法を習ったはずです(番号順に適用)。
- 単体原子の酸化数は0とする。
- 分子の価数と各原子の酸化数の和は等しい。
- アルカリ金属元素の酸化数は+1
アルカリ土類金属元素の酸化数は+2 - Hの酸化数は非金属との組み合わせで+1、金属となら−1
- 酸素の酸化数は基本的に−2
- ハロゲンの酸化数は基本的に−1
初等的な化学であれば、この規則を用いればほぼ全ての化合物における酸化数を求めることができますが、原理を理解すればこのような規則を考える必要はありません。
例えば、水において、Hの酸化数は+1、Oの酸化数は−1ですが、一方で過酸化水素においてはHの酸化数は+1、Oの酸化数は−1になります。なぜでしょうか。
これは、過酸化水素の構造が分かればすぐに理解できます。
高校生にとってはあまり馴染みがないかもしれませんが、過酸化水素は2つのヒドロキシ基が互いに結合している構造の分子です。
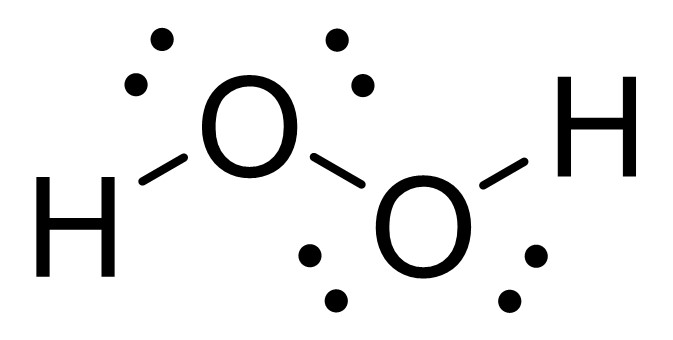
中央にある2つのOは互いに電子を共有しているので、O−O結合の電子は1つずつ分け合っていると考えます。また、電気陰性度はH<Oなので、H−O結合の電子2つはOが所有しているものと考えます。
すると、酸素原子は7個の電子をもっており、通常は6つであることから、酸化数は−1であると考えることができます。
形式電荷との違い
酸化数と類似した概念として、形式電荷があります。2つの違いは、結合性の解釈の違いです。酸化数はイオン結合に近似しますが、形式電荷は共有結合として近似します。
共有結合は、2つの原子がお互いに1つずつ電子を出し合って形成する結合です。そのため、たとえイオン結合性であったとしても、結合中の2つの電子は互いの原子にそれぞれ一つずつ帰属されると考え、仮想的に価数を導くことになります。
このような理由から、電気陰性度を考慮して電子を割り当てる必要がなく、簡単に算出できます。
形式電荷については、こちらをご覧ください。
