アルカンは反応性が極めて低いので、紹介する内容は2つしかありません。サクッと学習してしまいましょう。
本記事では、アルカンの反応性について解説します。
アルカンは全然反応しない
アルカンは反応性が極めて低いです。
その理由として、アルカンが炭素と水素の共有結合または炭素と炭素の共有結合のみで構成されていて、結合が強固であること、対称性が高いことが挙げられます。
そのため、紹介する反応もわずか2つです。
アルカンの燃焼
アルカンは高温条件下で酸素と酸化還元反応を起こします。例えば、メタンは次のように反応します。
CH4 + 2O2 → CO2 + 2H2O
これは燃焼反応として知られています。
この反応で重要な点は二酸化炭素が生成することです。二酸化炭素は非常に安定で、生成されるときに大きな熱を発します。
これは火力発電の原理と同じです。人口増加や産業の発展に伴って多くのエネルギーが必要になったため、アルカンを初めとする化石燃料を大量に燃やしてエネルギーを得ています。
そのため、二酸化炭素は増え続け、地球温暖化の原因になっていると考えられています。
余談ですが、二酸化炭素が地球温暖化の原因となっている決定的な証拠はありません。
光によるハロゲン化
アルカンに紫外線を照射すると、ハロゲンと置換反応を起こします。
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
この反応はラジカル反応と呼ばれます。ラジカルとは、不対電子をもつ化学種のことで、上記の反応では書いていませんが、塩素が光によって均一に開裂(ホモリシス)し、ラジカルを形成します。
ラジカル反応は一般に、開始反応、生長(成長)反応、停止反応の段階を経て反応します。以下に、メタンと塩素のラジカル反応の一部を示します。
1. 開始反応
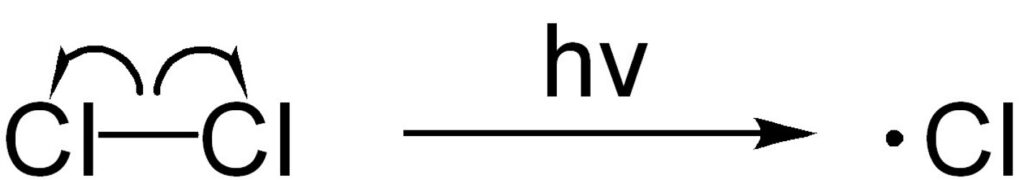
2. 生長反応
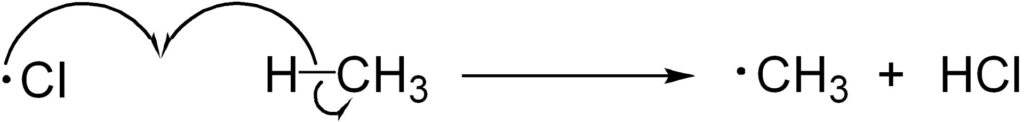
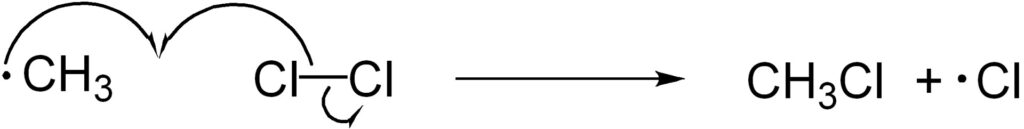
3. 停止反応
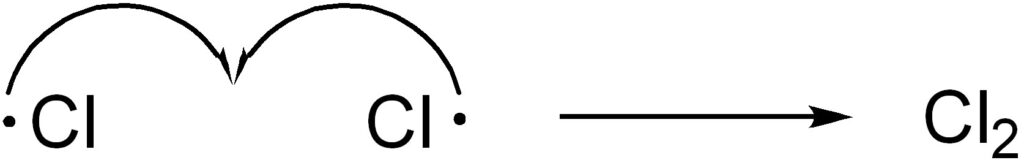
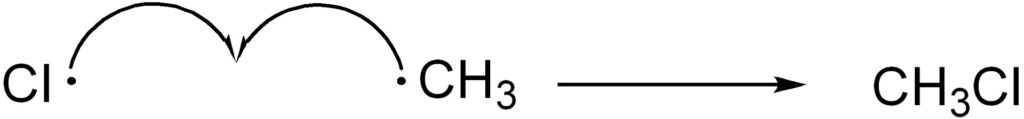
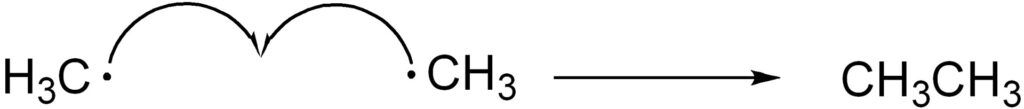
ラジカル反応のように電子が1つずつ動くときは片矢印(矢の先端が半分だけの矢印)を用いて電子の動きを表現します。
また、 生成物の慣用名は覚えておくほうがいいかもしれません。
CH3Clを塩化メチル、 CH2Cl2を塩化メチレン、 CHCl3をクロロホルム、 CCl4を四塩化炭素といいます(四塩化炭素だけ慣用名っぽくないですが、IUPACの命名法に従えばテトラクロロメタンですので、実は慣用名です)。
塩素分子に紫外線を照射すると開始反応が起こり塩素ラジカルが生成します。
ラジカルは非常に不安定で反応性に富んでいます。
その後、その塩素ラジカルがメタンと反応し、メチルラジカルを生じます。
メチルラジカルが塩素と反応すると、再び塩素ラジカルを生じます。このように、ラジカル反応によっては再びラジカルが生じ得るため、爆発的に反応が進みます。
この反応が止まるのは停止反応が起こったとき、すなわちラジカル同士が反応するときになります。
余談ですが、オゾン層の破壊はラジカル反応によるものです。
ラジカル反応は爆発的に進行することから、一度ラジカル反応が起こってしまだけでもオゾン層へのダメージが大きく、かつ反応を人為的に止めるのが困難であるため、問題視されています。
このようなことから、オゾン層に穴が空いてしまい一時期話題になりました。この穴をオゾンホールと言います。なお、現在は改善され、オゾンホールはなくなりました。
以上がアルカンとハロゲンの光によるラジカル反応になります。
なお、高分子化学ではこの3つの素反応のほかに連鎖移動反応という素反応もあります。現時点で知っておく必要は全くないのですが、興味があれば詳しくはこちらの記事をご覧ください。
