Fischerエステル化は、その簡便さから学生実験でよく行われます。また、カルボニルの反応としても授業で習う機会があるでしょう。
本記事では、Fischerエステル化の反応機構や、その長所、短所を解説します。
Fischer(フィッシャー)エステル化の反応機構
Fischer(フィッシャー)エステル化は、代表的なエステル化の機構の一つです。反応機構は以下の通りです。
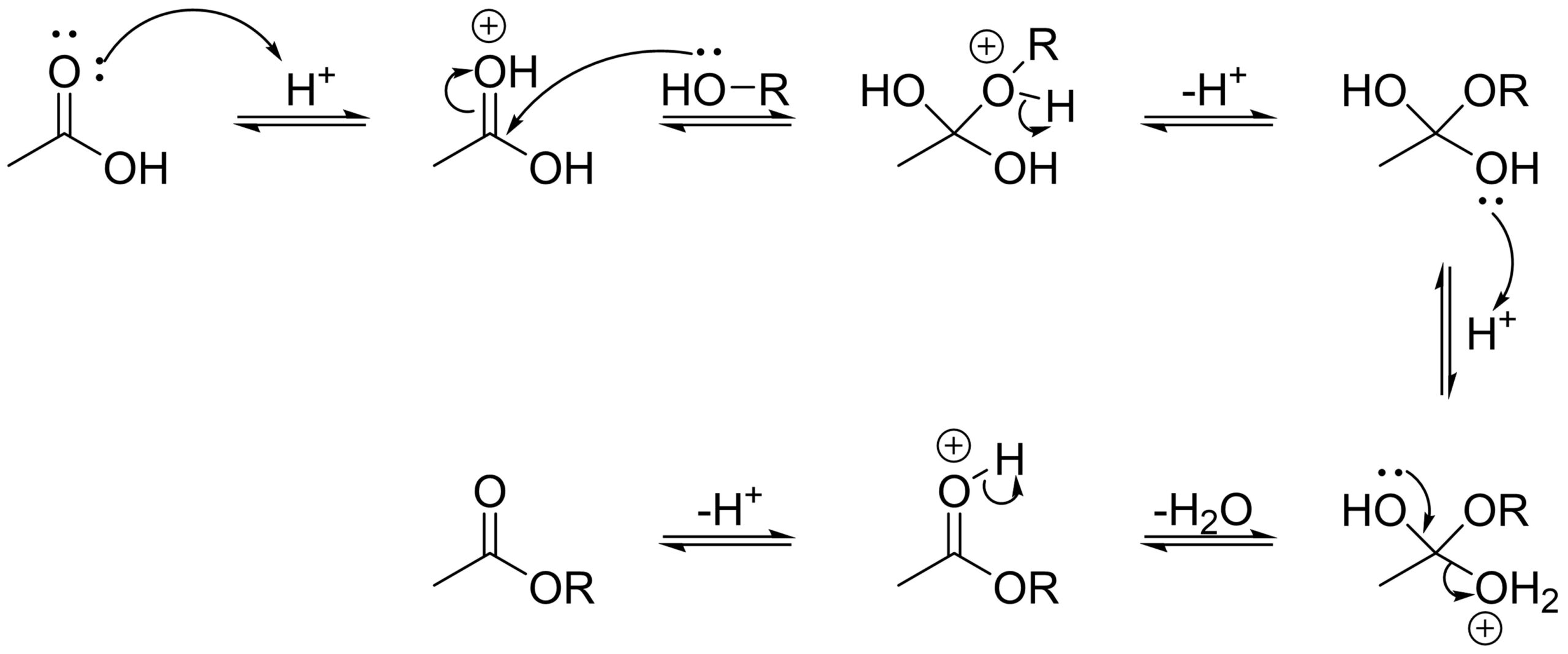
酸触媒下で、カルボニル基の酸素にプロトンが付加した化合物に対してアルコールがカルボニル基の炭素に攻撃し、四面体の中間体を形成します。
さらに、ヒドロキシ基にプロトンが付加すると水の脱離が起こります。次いでプロトンの脱離が起こり、最終的にエステルが得られます。
このような、カルボニル炭素に求核剤が攻撃し、次いで脱離能の高い置換基(今回の場合はROHよりもH2Oのほうが脱離しやすい)が脱離する反応を求核アシル置換反応といいます。この反応は工業的に重宝されていますので、おそらく化学系の授業で取り扱うかと思います。
しかし、大学のカリキュラムを考えると、このあたりの内容はかなり最後のほうで習うはずです。そのため、授業の進度や有機化学の先生の方針によっては急ぎ足で学んだ方もいるかもしれません。あるいは、一切学ばない場合もあるでしょう。
そのため、お手元に有機化学の教科書があれば一読することをお勧めいたします。カルボニルの反応は有機化学の面白いところが詰まっています。
さて、実験では未反教科書がボン酸や不純物を取り除くかと思います。学生実験で最もよく使われる方法は抽出でしょう。
抽出はかなり昔から利用されていた方法です。得られた溶液を(一般に)水と有機溶媒の混合液に入れ、よく振ります。
すると、水と有機溶媒は混ざりあわず、層が二つ現れます。このとき、生成物の水と有機溶媒に対する溶解度の違いから、生成物が水に溶ける場合は水層に、有機溶媒に溶ける場合は有機層に移動します。
今回の場合であれば、未反応のカルボン酸を塩基で中和し、水溶性である塩を作り、水層に移動させることで不純物の分離が可能です。
メリット
Fischerエステル化のメリットは、何といってもその単純さでしょう。
必要な材料はカルボン酸、アルコール、酸触媒の3つだけで、これら3つの試薬は特段危険性も高くありません。そして、実験工程もシンプルです。
それゆえに学生実験でもよく取り扱われるテーマになっているのだと思います。
デメリット
デメリットは、反応速度が遅いことやFischerエステル化が平衡反応であることです。
まず、四面体中間体が安定であることから活性化エネルギーが大きく、どうしても反応速度が遅くなってしまいます。
これはどういうことでしょう。見方を変えてみましょう。四面体中間体に結合している官能基に注目します。
この中で一番脱離しやすいのはアルコキシドRO−です。しかし、アルコキシドが脱離するということは逆反応が起こるとに等しいので、これではエステルの生成にたどり着きません。
しかし、そのような中でもヒドロキシ基HO−が脱離する場合も少なからずあります。こうなってくれると晴れて反応が進むわけです。
また、Fischerエステル化は全素反応において平衡反応です。エステルは水と加水分解を起こしてカルボン酸とアルコールになってしまうため、生成系に平衡を偏らせなければなりません。
そのため、アルコールを過剰量加える、生成する水を取り除くなどして、工夫する必要があります。
水を系外へ除く装置としては、ディーン・スターク装置がよく知られています(学生実験ではあまり使われないかもしれませんが)。
加えて、アルコールの級数が大きいと反応しにくくなります。
これは単純に立体障害によるものです。求核剤が嵩高い置換基をもっていれば、カルボニル炭素に攻撃しにくくなることは容易に想像できるかと思います。
参考文献
- Emil Fischer, Arthur Speier, Chem. Ber., 1985, 28, 3252.
https://doi.org/10.1002/cber.189502803176 - 有機化学の教科書(有機化学の教科書ならFischerエステル化は必ず載っているでしょう)
