モリブデンブルー法を用いたリン酸イオンの定量は、学生実験でしばしば取り組まれます。
ある大学の学生実験では、コーラに含まれるリン酸イオンをモリブデンブルー法で定量する実験をしていると聞いたことがあります。
本記事では、モリブデンブルー法の原理や中間体、レポートを作成する際に役立ちそうな参考文献などについて解説します。
モリブデンブルー法の概略(反応、中間体、測定法)
リン酸イオンの定量方法に、モリブデンブルー法という方法があります。
強酸溶液中で、リン酸イオンはモリブデン酸と反応してモリブデンイエロー(リンモリブデン酸、PMA)H3PO4(MoVIO3)12と呼ばれる黄色の錯体を形成します。
PO43− + 12MoO42−+ 27H+ → H3PO4(MoVIO3)12 + 12H2O
なお、上付き文字で記されたローマ数字は酸化数を表しています。
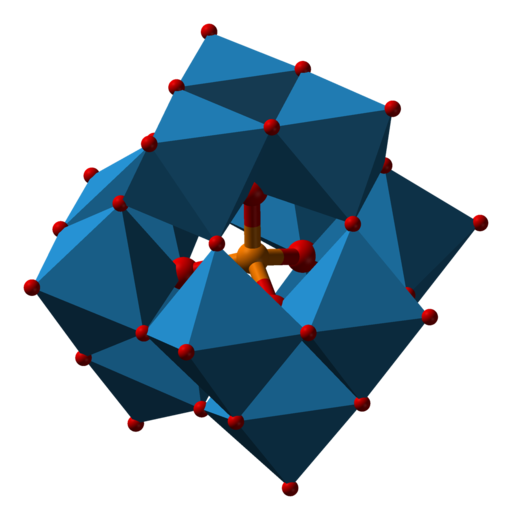
上の図1に示したのがモリブデンイエロー(リンモリブデン酸イオン)の構造です。中央にあるのがリン酸イオンPO43−で、その周りに12個のモリブデン酸MoO3が取り囲んでいます。
図中で水色で示されているMoO6の八面体が頂点や稜を共有しているのがわかります。加えて、中央のリン酸イオンは四面体構造を有しています。
また、モリブデンイエローのようなオキソ酸の縮合体はポリ酸(ポリオキソメタレート, polyoxometalate)と呼ばれます。
ポリ酸は多様な構造が見つかっていますが、モリブデンイエローはその中でもKeggin(ケギン)型の構造をとることが知られています。
次に、このモリブデンイエローを還元剤で還元すると、青色のモリブデンブルー(PMB)[H4PO4(MoVIO3)8(MoVO3)4]3−が生成します。
H3PO4(MoVIO3)12 + Reductant → [H4PO4(MoVIO3)8(MoVO3)4]3−
モリブデンブルーの構造は使用する還元剤によって構造が多少異なります。
また、始原系には6価のモリブデンが12個あるのに対して、生成系では6価のモリブデンが8個、5価のモリブデンが4個存在することから、この反応が4電子反応であることがわかります。
すなわち、次のように反応を書き換えることができます。
H3PO4(MoVIO3)12 + 4e− → [H4PO4(MoVIO3)8(MoVO3)4]3−
今回の生成物のように、ある原子が複数の酸化数をもつような化合物を混合原子価化合物と言います。この種の化合物は混合原子価状態の原子間での電子移動に起因して鮮やかな青色を呈することが良く知られています。顔料で有名なプルシアンブルーも混合原子価化合物です。
このようにして青色に発色した溶液の紫外可視吸収スペクトルを計測し、既知濃度のリン酸溶液を用いて検量線を作成、Lambert-Beerの法則から試料中のリン酸濃度を求めるのが一般的です。
ちなみに黄色のモリブデンイエローも分光光度計で定量できるのですが、モリブデンブルーを用いたほうが感度がいいことが知られています。モリブデンブルーは真っ青(もはや黒く見える)なので、少量でも検出できるという利点があります。
モリブデンブルー法の一般論
この反応は1783年にScheeleによって言及されましたが、その発見は広くBerzelius(1826)によるものとされています。
Berzeliusが1826年に報告したリンモリブデン酸アンモニウム(NH4+)3[H4PO4(MoVIO3)8(MoVO3)4]3−は初めて発見されたモリブデンブルーで、かつに初めて報告されたKeggin型構造の化合物でもあります。
当記事で紹介しているモリブデンブルーは中心にリンを含む化合物ですが、リン以外にケイ素やヒ素、ゲルマニウムが中心に存在するものもあり、これらもモリブデンブルーと呼ばれます。モリブデン(VI)酸化物を含む青色顔料もモリブデンブルーと呼称されます。
オルトリン酸塩(PO43−)は、XO4型の他の四面体アニオンと同様に、Xがヘテロ原子である組成[Xn+Mo12O40](8−n)−のイオンを形成することが知られています。
これらの化学種も同様に濃青色を呈し、分光学的な測定が可能です。
さらに、オルトリン酸塩の定量はpH 0−1で行うのが最適であることが経験的に知られています。
モリブデンブルー法はJIS K0101「工業用水試験方法」として採用されています。
参考文献
- (モリブデンブルー法の総説論文)
Nagul, E.A., S.D Kolev, I.D. McKelvie, P.J. Wordfold, Anal. Chem. Acta, 2015, 890, 60. DOI: https://doi.org/10.1016/j.aca.2015.07.030 - JIS K 0101:2017, 工業用水試験方法
