形式電荷は特に有機化学で頻繁に登場する重要な概念です。しかし、実際の電荷と勘違いされているきらいがあります。
本記事では形式電荷の意味と計算方法について解説します。
形式電荷とは
形式電荷は、分子中の特定の原子がもつ「形式的な」電荷を表した概念です。形式電荷を考えるときは、あらゆる化学結合を共有結合と仮定することで、電荷を考えます。
共有結合は互いの原子が電子を1つずつ共有しあって作り上げられる結合ですので、互いの原子はそれぞれ電子を1個もっているとします。
例えば、オゾンO3はどうでしょう。
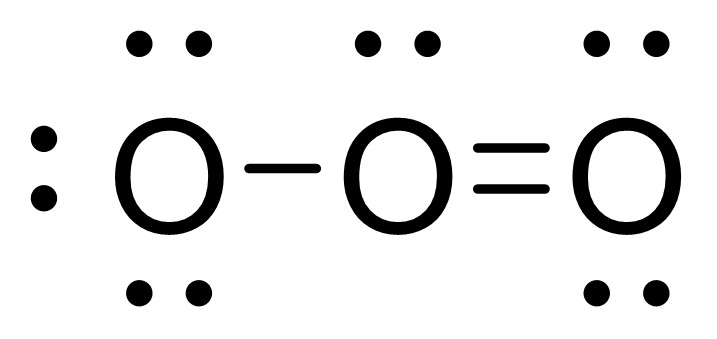
オゾンは共有結合性なので、深く考える必要はありません。一番左の酸素は、非共有電子対として6個の電子と、共有結合由来の電子1つの、計7個の電子をもっていると考えます。
すると、酸素の価電子数は6個のはずなので、1つ電子を多くもっていることがわかります。そのため、一番左の酸素の形式電荷は−1とわかります。
次に、真ん中の酸素に着目します。先ほどと同様にして考えると、この酸素は5個の電子をもっているとみなすことが得きます。そのため、形式電荷は+1です。
最後に、一番右の酸素に注目すると、形式電荷は0であることがわかります。
このようにして算出した形式電荷は、分子構造中では+や−で表記されます。
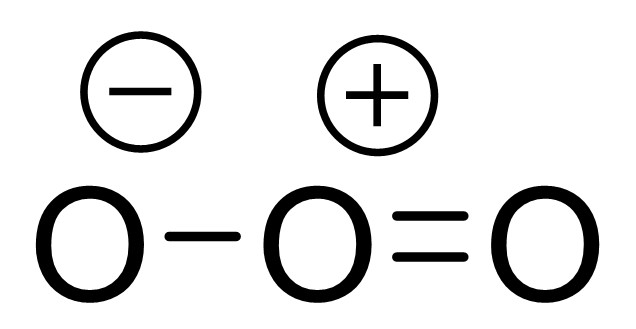
通常、形式電荷をもつ原子の右上に形式電荷を書き記します。例えば、形式電荷が+1または−1の時はそれぞれ+, −と書けばよいのですが、形式電荷の絶対値が2以上の時は、「2−」のように+, −の前に形式電荷の絶対値を書きます。
また、形式電荷が+1または−1のとき、+や−を丸で囲むこともあり、この書き方は主に有機化学で見られます。
別の例として、塩化ナトリウムNaClについて考えてみましょう。塩化ナトリウムはイオン性の分子ですが、これを共有結合性の分子だとみなします。
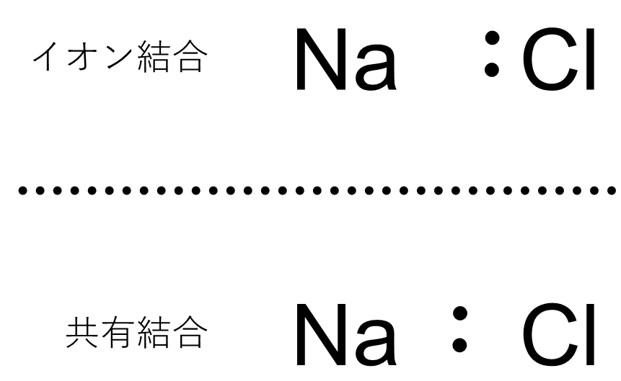
NaとClの結合に使われている電子は、本来ならClが電子2つを出してNaと結合していると考えるべきなのですが、これを共有結合で考えると、NaとClはお互いに電子1つを出し合って結合していると考えます。
このとき、NaとClはそれぞれの価電子数に相当する数の電子をもっているので、形式電荷は共に0です。
酸化数との違い
形式電荷とよく似た考え方として、酸化数があります。酸化数は、化学結合をすべてイオン結合として考えたときに導き出される仮想的な電荷のことです。
つまり、形式電荷と酸化数は、化学結合をすべて共有結合とするかイオン結合とするかという点で異なります。酸化数についての詳しいことはこちらをご覧ください。
有機化学との関係性
形式電荷は有機化学で重要な役割を果たしています。これはおそらく、有機分子は電気陰性度にあまり差がないCとHから主に構成されており、共有結合性を仮定する形式電荷と相性がいいためではないかと思います。
一方、酸化数はイオン結合性を仮定しているため、有機化学との相性はイマイチだと思われます。実際、私が有機化学を勉強していて酸化数が重要になる場面に出くわしたことは一度もありません。
また、有機化学では共鳴構造を描く場面に多く遭遇しますが、この際も形式電荷がカギとなります。
