混成軌道は大学化学の初級レベルの内容ですが、その意味を理解するのは初学者にとって少し難しいのではないかと感じています。
本記事では、混成軌道の概要と、有機化学で特に重要なsp3混成軌道, sp2混成軌道, sp混成軌道について解説します。
混成軌道の概要
原子同士がどのようにして結合しているかを説明するために、混成軌道を導入します。
混成軌道には様々な種類が存在しますが、その中でも特に有機化学で頻繁に用いる、sp3混成軌道、sp2混成軌道、sp混成軌道について説明します。
混成軌道とは、複数の軌道を混ぜ合わせる(混成する)ことでできる新たな軌道のことです。
たとえば、1つのs軌道と3つのp軌道(px, py, pz)を混成して得られる軌道をsp3混成軌道といいます。pの右上にある添え字の3は、3つのp軌道を用いて混成したことを意味します。
具体的には、LCAO法(Linear conbination of Atomic Orbital)と呼ばれる方法で各軌道の波動関数を線形結合することで混成軌道が得られます。詳しいことは分からないままでも問題ありません。
混成軌道は原子価結合法と呼ばれる理論をもとにして作られました。しかし、この理論では不完全で、説明できないことが多いため、現在は分子軌道法と呼ばれる理論を用いて結合に関する議論がなされます。
ただし、混成軌道の考え方は定性的には十分通用し得るので、現在でも頻繁に使われています。
sp3混成軌道
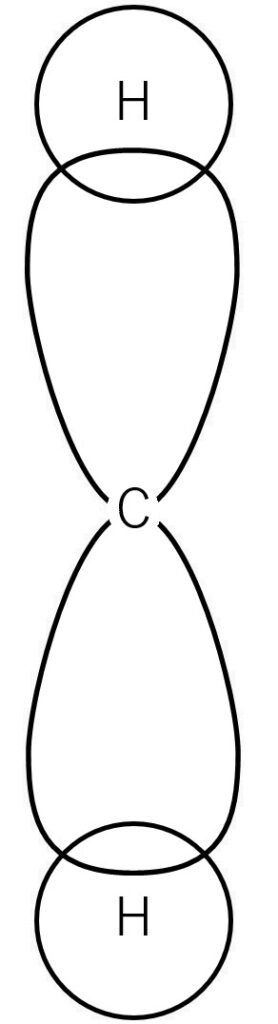
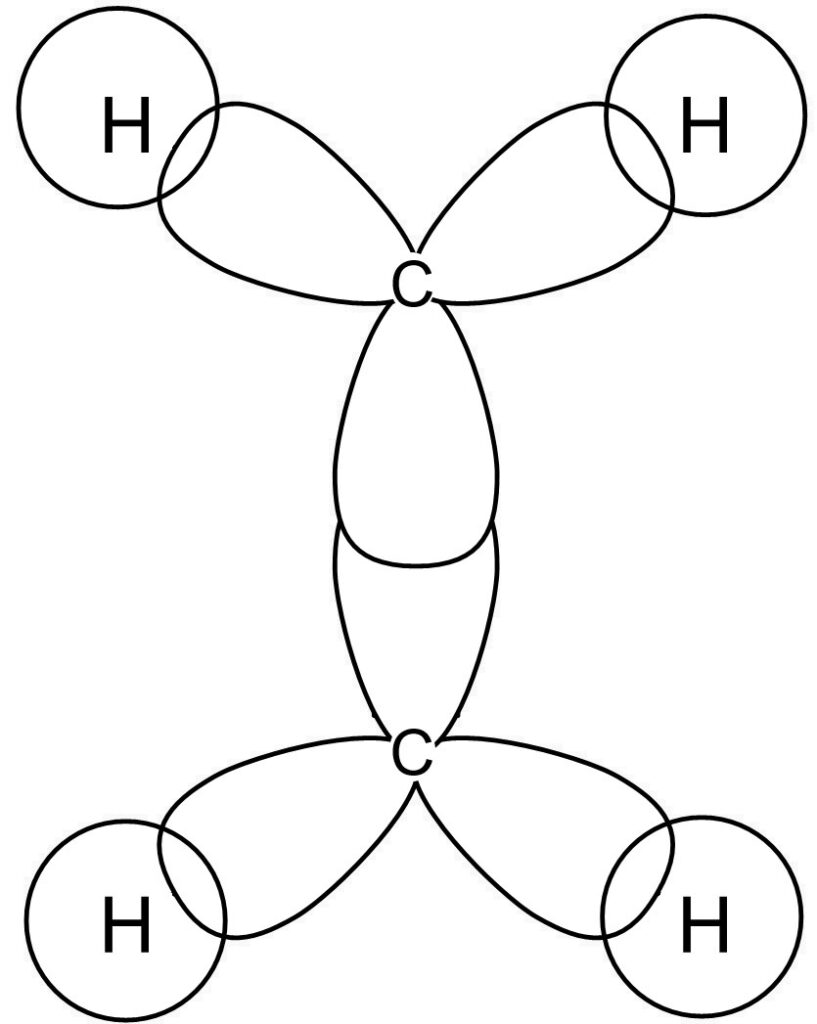
CH4の化学式で表されるメタンは、炭素に4つの水素が結合しています。
また、炭素原子Cは自らの2s軌道と2p軌道にある電子が水素の1s軌道にある電子とそれぞれ電子を共有しあって結合していることが知られています。
そのため、2s軌道と1s軌道からなる結合と2p軌道と1s軌道からなる結合がそれぞれ2つずつ存在することになります。
この2つの結合はそれぞれ相異なるものであると考えられますが、実際はどの結合も全く同じものであることが知られています。
また、水素の位置は炭素を中心とする正四面体の頂点に存在します。これは、水素同士が近すぎると不安定だからです。水素原子4つが最も離れるためには、正四面体の頂点に位置する他にありません。
これらの条件を表現できるのがsp3混成軌道です。この混成軌道は、炭素がもつ1つの2s軌道と3つの2p軌道(px、py、pz)を混成して得られるため、sp3と表記されます。
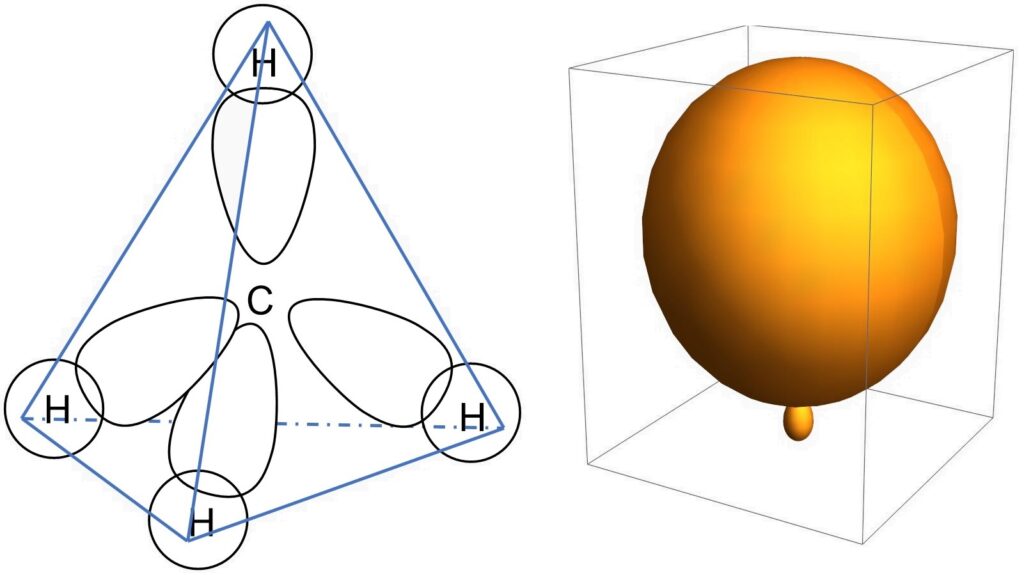
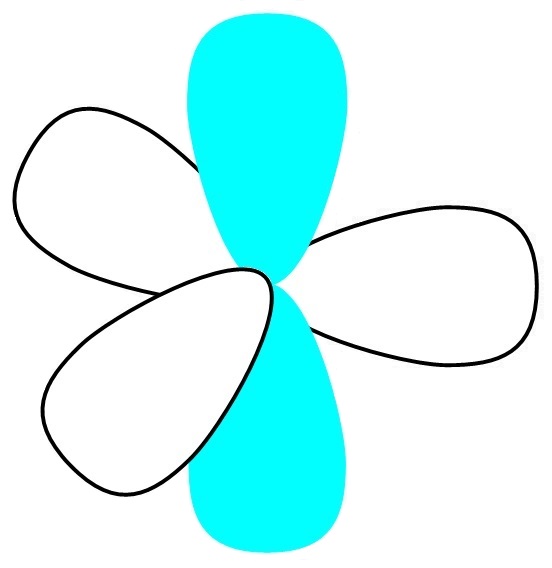
図1の右にあるローブの形を見ると、大きいローブと小さいローブがあることが分かります。
小さい方よりも大きい方が電子がいる領域が広い分、より結合を作りやすいため、小さい方のローブはこれからの議論では無視することにします。また、結合角は109.45 °前後です。
sp2混成軌道
C=Cの二重結合をもつ化合物のうち、最も単純なエチレンについて考えます。片方のCに着目すると、C-Hの単結合が2つ、C=Cの二重結合が1つあります。
ここで、2s軌道と、3つのうち2つのp軌道を混成してsp2混成軌道を作ってみます。数学的に計算すると、sp2のローブが平面上に3つ、余ったp軌道がその面に垂直に存在することが分かります。
ローブの形はsp3混成軌道のものとほとんど同じです。結合角は120 °です。
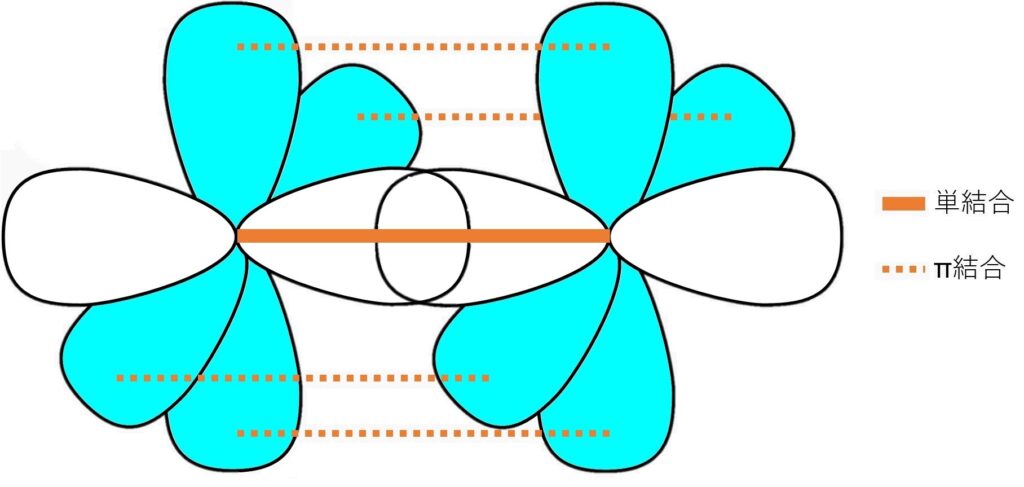
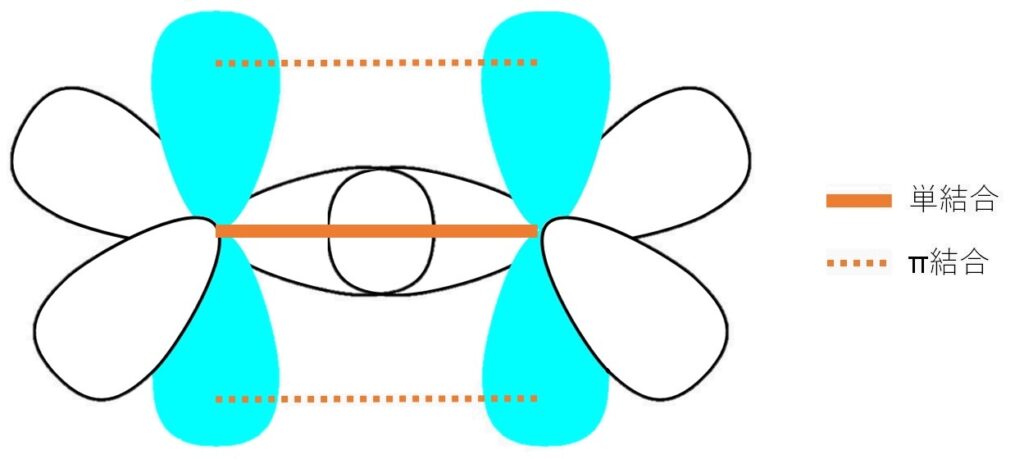
エチレンの二つの炭素がこのsp2混成軌道をなしていて、1組のsp2のローブがσ結合、p軌道の接近でπ結合を形成することで二重結合となっています。
(「σ結合」は片方のローブをを回転させても結合に変化がない結合、π結合は片方のローブを回転させると180度おきに再びローブ同士が重なる結合を指します。)
sp混成軌道
C≡Cの三重結合をもつ化合物のうち、最も単純なアセチレンについて考えます。先ほどと同様にして、片方のCに着目すると、C-Hの単結合が1つ、C≡Cの三重結合が1つあります。
ここで、2s軌道と、3つのうち1つのp軌道を混成してsp混成軌道を作ってみます。数学的に計算すると、spのローブが直線状に2つ、余った2つのp軌道がその直線に直行するように存在することが分かります。
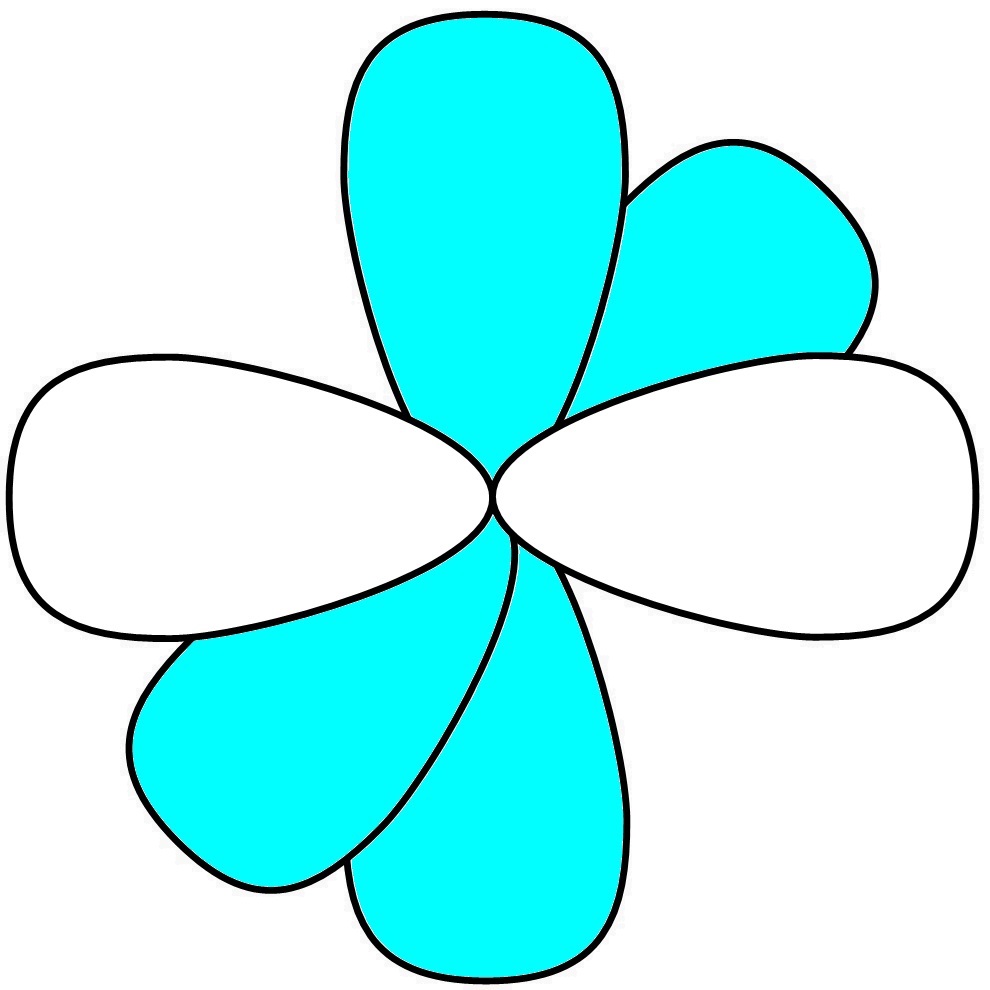
ローブの形はsp3やsp2混成軌道のものとほとんど同じです。結合角は180 °です。
こちらもエチレンと同様に、アセチレンの二つの炭素がsp混成軌道をなしていて、1組のspのローブがσ結合、2組のp軌道の接近でπ結合を形成することで三重結合となっています。