有機化学を学んでいれば、+やδ+(デルタプラス)といった表記を見かけますが、皆さんはこれらの違いを理解しているでしょうか。本記事では、+やδ+(−やδ−)の違いについて解説します。
+は形式電荷 δ+は酸化数っぽいもの
結論から申し上げますと、
+は形式電荷、δ+は酸化数っぽい概念です。
形式電荷や酸化数については別の記事で詳しく紹介しています。是非ご覧ください。
形式電荷についてはこちら。
酸化数についてはこちら。
簡単に説明すると、形式電荷はすべての結合を共有結合と仮定して導かれる電荷のことです。
一方で、酸化数はすべての結合をイオン結合と仮定して導かれる電荷のことです。
つまり、+とδ+はどちらも電荷に関する概念ですが、その原理が異なります。
ここで注意があります。δ+は誤解を恐れずに言えば酸化数なのですが、δ+の表記をするときは完全なるイオン結合としているわけではありません。
そもそもδというのは「少し」といった意味合いがあります。つまり、δ+というのは少しプラスに帯電しているという意味です。すなわち、完全にイオン結合になっているという考えではなく、イオン結合と共有結合の間にあると解釈します。このような結合を極性共有結合と言ったりもします。
さて、ここまでで二つの違いを説明しましたが、これらはどのような場面で使われるのでしょうか。
ここではもっとも代表的な例で、有機化学において最も重要な電子的効果である誘起効果(inductive effect, i効果)と共鳴効果(resonance effect, r効果)について説明します。
誘起効果
誘起効果とは、σ結合を通じて起こる原子(団)の電子的効果です。この誘起効果は電気陰性度の違いによって引き起こされます。
具体例を示します。次に示す2つの似た化合物のうち、どちらがより酸性でしょう。

二つの違いは、メチル基の水素がフッ素に置換されているか否かです。また、電気陰性度を考えるとH<C<Fです。
つまり、トリフルオロ酢酸およびトリフルオロ酢酸イオンにおける炭素原子はδ+になっていることがわかります。
一方で、炭素原子と水素原子の電気陰性度はあまり違いませんが、強いて言うなら炭素原子のほうが電気陰性度大きいため、酢酸および酢酸イオンにおける炭素はδ−になっていることがわかります。
いま、共役塩基に注目します。共役塩基は負電荷をもつため、これをできるだけ分散させたほうが静電気的に安定です。
ここで、誘起効果が威力を発揮します。
トリフルオロ酢酸イオンについては、フッ素が負電荷を引き寄せてくれるので、電荷の偏りがある程度解消されます。そのため、トリフルオロ酢酸イオンは酢酸イオンに比べて安定です。したがって、トリフルオロ酢酸のほうが強酸であることがわかります。
見方を変えてみましょう。やはり誘起効果の影響で、酢酸イオンのほうがトリフルオロ酢酸よりも電荷に偏りが生じます。具体的には、酸素原子付近の電子密度が大きいはずです。そのため、電子を求めて水素イオンが引っ付きやすいことがわかります。すなわち、酢酸イオンは電離しても元に戻りやすいということになります。したがって、トリフルオロ酢酸のほうが強酸であることが説明できました。
共鳴効果
共鳴効果は、π共役系を通じて起こる原子(団)の電子的効果です。共鳴によって形式電荷が動くのでした。
共鳴についてご存じない方はこちら。
同様に具体例を用いて説明します。フェノールとメタノールの酸性度について考えます。
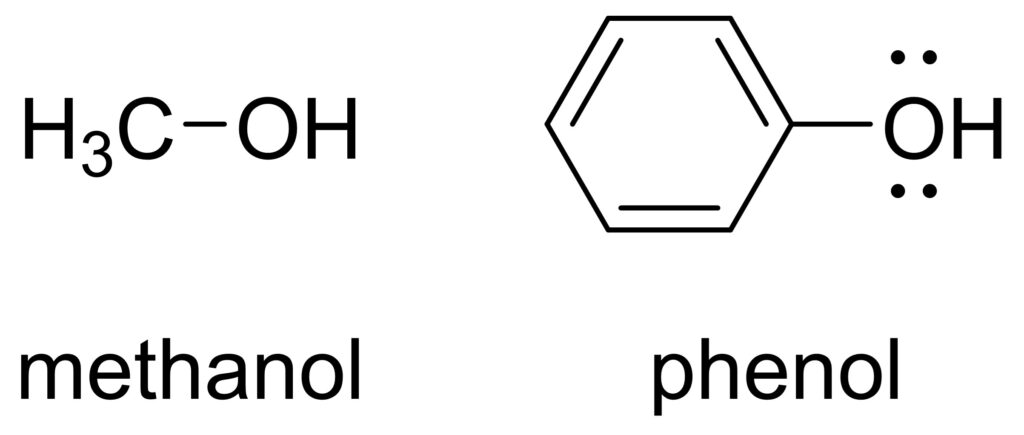
先ほどと同様、共役塩基について考えます。フェノールの共役塩基は、次のように共鳴が描けます。

ここで、マイナスを丸で囲ったマークは形式電荷を意味する「−(マイナス)」と一緒です。
このように、メトキシドイオンとは違って、フェノキシドイオンは共鳴安定化の寄与を受けるので、フェノールのほうが強酸です。
見方を変えると、共鳴構造からわかるように負電荷がベンゼン環に分散されるので、プロトンの付加が起こりにくいことがわかります。すなわち、フェノールはメタノールに比べて強酸であると言えます。
