酸塩基反応は有機化学において最も重要な反応といえます。
その中で、Brønsted-Lowryの酸塩基では酸解離定数Kaが定義され、実用的にはこれの常用対数に負号を付けた値pKaが良く用いられます。
本記事では、pKaからわかる酸塩基反応における平衡の偏りを解説します。
ブレンステッド−ローリーの定義
酸塩基の定義は主に3つありますが、当記事ではブレンステッド−ローリー(Brønsted-Lowry)の定義を紹介します。
H+を供与する物質を酸、H+を受容する物質を塩基とする。また、ブレンステッド−ローリーの定義を満たす酸と塩基をそれぞれブレンステッド酸、ブレンステッド塩基ということがある。
ブレンステッド−ローリーの定義における酸塩基反応は一般に次のような平衡反応になります。
HA + B ⇄ A− + HB+
逆反応も起こるため、HB+は酸、A−は塩基であると言えます。このとき、HB+をBの共役酸、A−をHAの共役塩基と呼びます。
ブレンステッド−ローリーの定義はアレニウス(Arrhenius)の定義を拡張したものと解釈できます。
アレニウスの定義とは、水中で解離してH+を放出する物質を酸、水中で解離してOH−を放出する物質を塩基とするものでした。
このとき、H+、つまり陽子(プロトン)は単体で存在すると不安定であるため水に配位してH3O+を形成することが知られています。
これを踏まえると、アレニウスの定義の酸は水にH+を供与しているため、ブレンステッド−ローリーの定義も満たすことがわかります。
同様に、OH−もH+を受け取ってH2Oになるため、やはりブレンステッド−ローリーの定義を満たします。
酸解離定数Kaの定義
ブレンステッド酸がプロトンを放出する反応は一般に次のような形で表現されます。
HA⇄H++A−
この反応の平衡定数を酸解離定数といい、Kaと書きます。
\[
K_{\mathrm{a}}=
\mathrm{
\frac{
[H^+][A^-]
}
{
[HA]
}
}
\]
本来は濃度ではなく活量の商になります。詳しくはこちらをご覧ください。
また、Kaの自然対数に負号を付けた値をpKaと書き、これを酸解離定数と呼ぶこともあります。
\[
\mathrm{p}K_{\mathrm{a}}:=-\log{K_{\mathrm{a}}}
\]
pKaが大きいほど、H+を放出しにくいため、酸としては弱くなります。そのため、HAがH+を放しにくい、あるいはA−がH+を受け取りやすい物質であると考えることができます。
pKaの意味から見る平衡の偏り
酢酸と塩酸のpKaはそれぞれ4.76と−3.7であることが知られています。ここで、次のような反応を考えます。
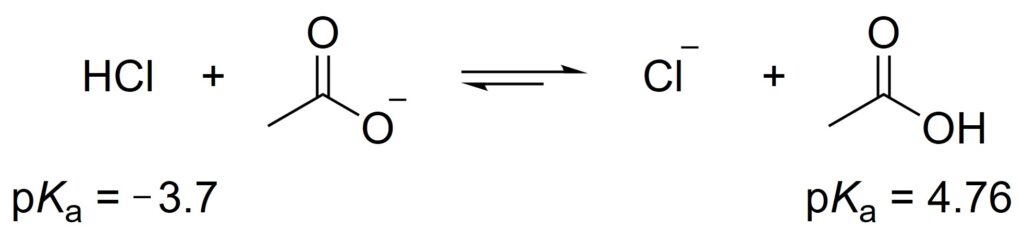
生成系に酢酸があるため、酸塩基反応が起こって反応系に戻る反応も起きますが、この系では生成系側に平衡が偏ります。なぜでしょうか。
pKaが大きいほど、H+を放出しにくいのでした。
いま、酢酸よりも塩酸のほうがH+を放出しやすいため、逆反応が起こって酢酸がH+を放し、塩化物イオンがH+をもらって塩酸になったとしても、すぐに塩酸はH+を放出すると考えられます。そのため、平衡は生成系に偏るとわかります。
また、このことから、塩基の強さについても議論することができます。
この反応においては、酢酸イオンが塩化物イオンよりも強い塩基であることがわかります。
塩化物イオンはH+を受け取ってもH+を放したがる、つまり塩酸のpKaが小さいため、塩化物イオンは弱い塩基であるといえます。
逆に、酢酸はpKaが大きく、H+を放しにくいため、酢酸イオンは強い塩基であると言えます。
一般に、酸塩基反応における平衡の偏りについて次のようなことが言えます。
酸のpKaが大きくなる方向に平衡は偏る。すなわち、酸のpKaよりも共役酸のpKaが大きいと、その反応は優位に進む。
この考え方は本当に重要です。単に暗記してしまったという方もいるかと思いますが、ぜひ理屈まで知っていただければと思います。
