共鳴は有機化学で頻出の重要な概念です。しかし、初学者にとっては何とも理解しにくいものではないかと思います。
本記事では、共鳴の根本的な説明や書き方について紹介します。
共鳴とは
酢酸イオンを考えてみます。酢酸イオンとは、酢酸のカルボキシル基−COOH基からH+が脱離した原子団CH3COO−です。
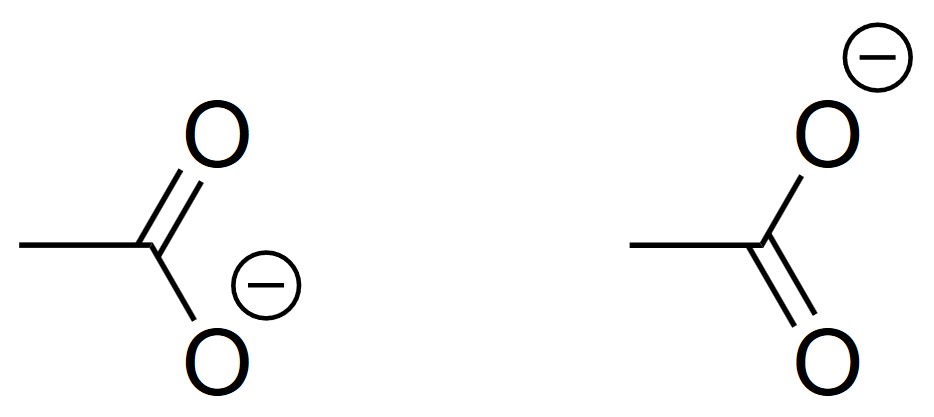
さて、二つの構造のうち、どちらが正しいのでしょう?つまり、どっちの酸素が二重結合を形成して、どっちが単結合を形成しているのでしょうか?
「どちらも同じではないか」と思った方、正解です。これらは等価な構造です。
では、これならどうでしょう。実験によると、酢酸イオンにおいてはC=O結合とC−O結合の長さが同一であることが分かっています。
しかも、その長さはC=O結合とC−O結合の中間値になっています。
これを踏まえて、もう一度。どちらの構造が正しいのでしょう?
普通、単結合よりも二重結合のほうが短いはずです。どうやって説明したらよいのでしょうか。
ここで、共鳴という概念が現れます。
共鳴理論では、酢酸イオンは図1に示した二つの構造の中間的なものだと考えます。今回の場合、COO−の部分が単結合と二重結合の間にあたる、いわば1.5重結合を形成すると考えます。
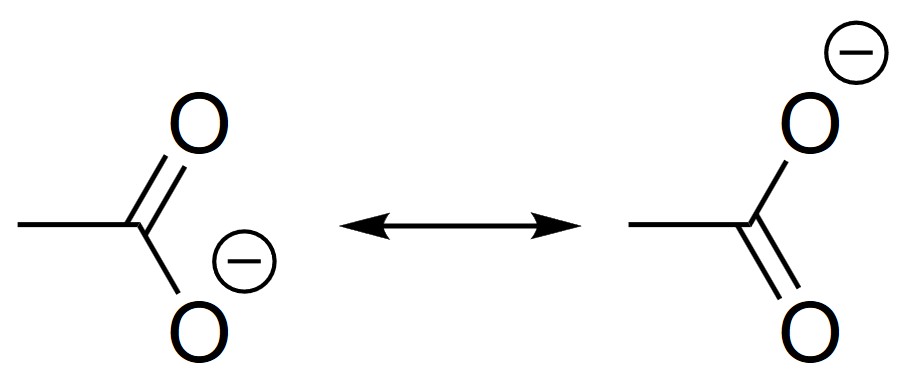
また、共鳴に関係する構造(共鳴構造)を両矢印でつなぐことによって共鳴を表現します。これを共鳴構造式と言います。
以下で詳しく説明します。
ポイントは共役
共鳴のポイントは、共役です。
酢酸イオンにおいては、C=O結合を形成するπ結合と、O−の非共有電子対のうち1ペアーは、いずれもp軌道中にあります。
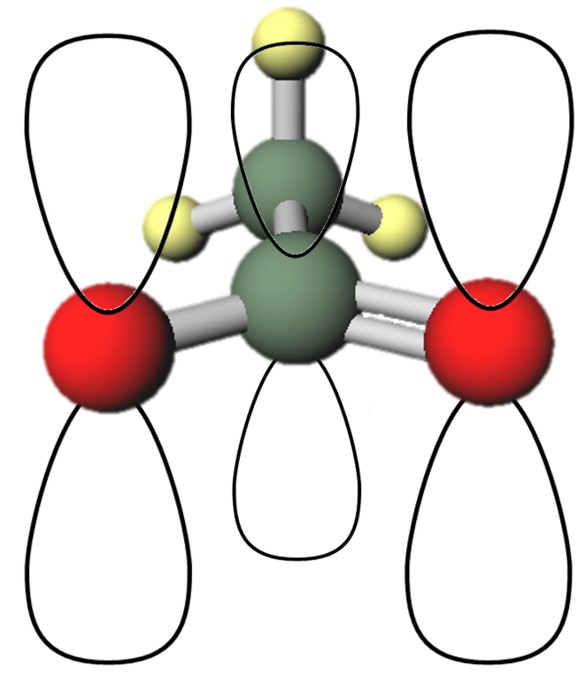
図3の奥にあるのがメチル基で、手前側にCOO−があります。図3では、手前側中央の炭素と手前側右側の酸素が二重結合を形成しているように描きました。
π電子(π軌道にある電子)と非共有電子対、つまり今回の場合はp軌道にある電子は、このように平行に並んだ軌道を通して広がることができます。
つまり、二重結合の部位に電子が偏るわけではなく、非局在化すると考えます。
このようなことから、C=O結合とC−O結合の長さが一致しているのです。というより、C=O結合とC−O結合のような単結合や二重結合のようにはなっておらず、いわば1.5重結合になっているのです。
共鳴は原子価結合法に基づいた理論です。これは、電子が各原子軌道に存在することを前提に電子の相互作用を取り扱う理論です。
また、上記の説明の途中から分子軌道法の考え方を取り入れました。分子軌道法とは、電子が分子全体に広がった軌道(分子軌道)に存在するという考えです。
そのため、原子価結合法で仮定していた共鳴は、分子軌道法を使えば自然に導入されます。
さて、共鳴にはいくつかの特徴があります。これらを理解すれば簡単に共鳴構造式を描くことができます。
規則1: 共鳴構造は仮想的
図2を見ると、酢酸イオンは2つの構造を行き来しているように見えますが、そうではありません。
繰り返しになりますが、酢酸イオンはこれらの中間に位置するような構造をとっていると考えます。これを共鳴混成体といいます。
また、一般の分子では、共鳴構造の数は2つとは限りません。もっと多くの共鳴構造をもつ化合物も多く存在します。酢酸イオンははあくまでも例として示しただけなので、ご注意ください。
繰り返しになりますが、共鳴は原子価結合法に基づいた理論です。そのため、電子が非局在化している構造同士を矢印で結んで共鳴を表現しているのです。
規則2: π電子が動くだけ
共鳴構造間では、π電子の位置が違うだけで、他は何も変わりません。例えば、共鳴構造間で各原子の位置は不変ですし、混成軌道も変化しません。
そのため、共鳴することを前提に混成軌道を考えなければなりません。
例えば、酢酸イオンのO−はp軌道を使って共鳴しているはずなので、sp3混成軌道は取れません。
sp2やsp混成軌道にして、余りのp軌道を確保する必要があります。ここではC=O二重結合をつくるため、sp2混成軌道とするのが適切でしょう。
*混成軌道がわからない方はこちら。
規則3: 共鳴構造は等価でなくてよい
酢酸イオンの共鳴構造は2つとも等価ですが、そうでなくても問題ありません。例えば、フェノールの共鳴構造式は次のようになります。
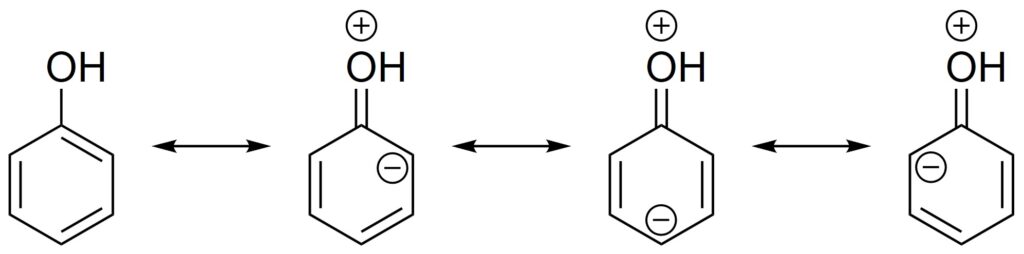
しかし、どの共鳴構造が共鳴混成体へ大きく寄与しているかはわかります。
フェノールの場合、電気陰性度の大きな酸素の形式電荷が正になっている構造は不安定であると考えられるため、共鳴混成体に最も寄与しているのは最も左側の構造であると考えます。
また、等価な共鳴構造が多くあるほど、その共鳴構造は共鳴混成体に大きく寄与すると考えます。
準規則: オクテット則を満たす
基本的にはオクテット則を満たすように共鳴構造を考えます。
しかし、特に無機化学の分野では、オクテットを満たさない例も少なくありません(超原子価化合物はその代表例でしょう)。
例えば、三フッ化ホウ素BF3はB−F結合を3つ持つ化合物です。この共鳴構造式を考えると、次のようになります。
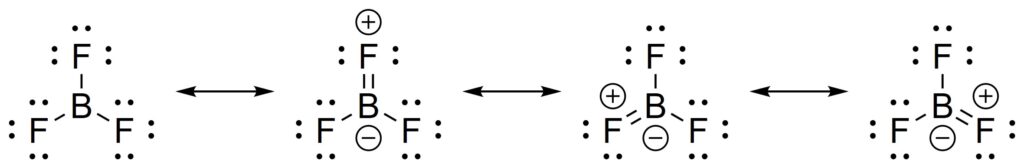
このとき、オクテット則を満たすのは一番左以外の3つです。また、残り3つの構造は等価です。このことから、B−F結合は二重結合性が強いのではないかと考えられそうですが、実際には単結合に近いことが知られています。
このように、必ずしもオクテット則が満たされるわけではなく、非オクテットの構造が共鳴混成体に働くこともあります。
さて、なぜ、わざわざフッ素からホウ素に電子が流れるのでしょうか。
これはホウ素が空のp軌道を持っていて、かつ電子を2つ受け取るとオクテット則を満たすからです。ホウ素は第3族元素なので、3つの電子をもっています。そのため、通常結合を3つ作ります。
しかし、オクテット則は満たされていません。そこで、フッ素の2p軌道にある電子が、ホウ素がもつ空の2p軌道を通して共鳴します。
このようなことから、三フッ化ホウ素の共鳴は図4のように描けるのです。
共鳴混成体はどの共鳴構造よりも安定
一般に、共鳴すると、どの共鳴構造よりも安定になります。これは数学的な帰着によるものです。また、共鳴構造が多いほど、より安定になります。
これを共鳴安定化といいます。
この共鳴が描けることによる安定化は有機化学において大切な考え方です。この先の学習で何度も出てくることでしょう。
なお、なぜ共鳴すると安定化するかを知るには、先ほど紹介した原子価結合法をしっかりと学ぶ必要があります。つまり物理化学の勉強をしなければいけません。
しかし、有機化学だけやる分には具体的に知らなくても特段問題ありません。
形式電荷の絶対値が小さいものが優勢
形式電荷の絶対値が小さいものほど共鳴混成体に大きく寄与すると考えます。例えば、ある二つの原子にそれぞれ+2と−2の形式電荷が割り当てられていた場合と、(先ほどと同じ原子でなくてもいいが、)+1と−1に割り当てられている場合では、後者の構造のほうがより共鳴混成体に寄与していると考えます。
初等的な電磁気学からもわかるように、互いに異符号の電荷をもつ二つの点電荷に働くクーロンポテンシャルは、電荷の絶対値が小さいほど小さくなるので、このように考えるのは妥当であると思われます。
以上のことを踏まえて、共鳴構造について考えていくことになります。慣れるまでは上記の要請を見ながら演習問題などを解いてみてください。
