立体化学、異性体とは
分子を3次元的な視点で眺める化学の学問を、立体化学といいます。
ある化合物Aにおいて、分子式は同じだが構造が違うような別の化合物Bがあったとき、BはAの異性体であるといいます。
異性体には非常に多くの種類があります。ここで説明する者はそのうちのほんの一部です。
配座異性体
エタンについて考えます。自分の目線にエタンの炭素2つが一直線上になるように配置してみます。すると、以下の図1のように見えます。
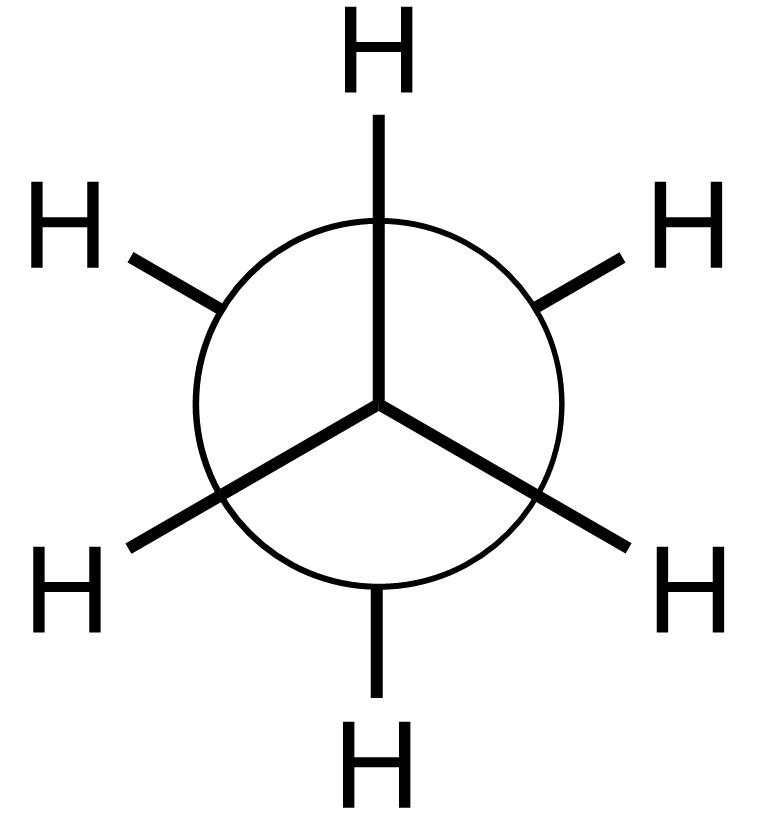
大きな丸は手前の炭素で、そこから三本の手が出ています。後ろの炭素は手前の炭素に隠れていて、後ろのC−H結合を表す三本の線は一部隠れています。このような表記をNewman投影式(ニューマン投影式)といいます。
後ろの炭素に結合した手を60°回転させると、次のような形にもなります。
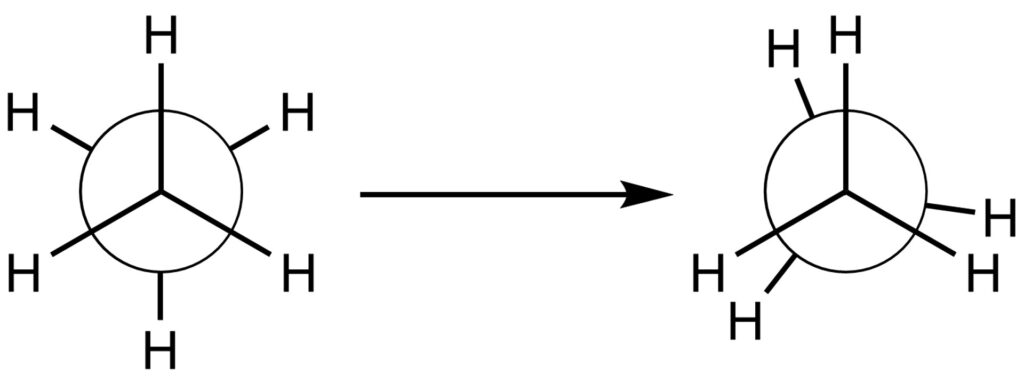
本当は水素原子同士が重なるのですが、それだと見づらくなるため重ねずに表記することが一般的です。
この時、左側のように水素原子が均等に広がっている構造をねじれ形配座、右側のような水素原子が重なっている構造を重なり形配座といいます。
通常、重なり形配座よりもねじれ形配座のほうが安定です。
今度はブタンについて同様に考えていきます。ブタンのねじれ形配座には2種類考えられます。
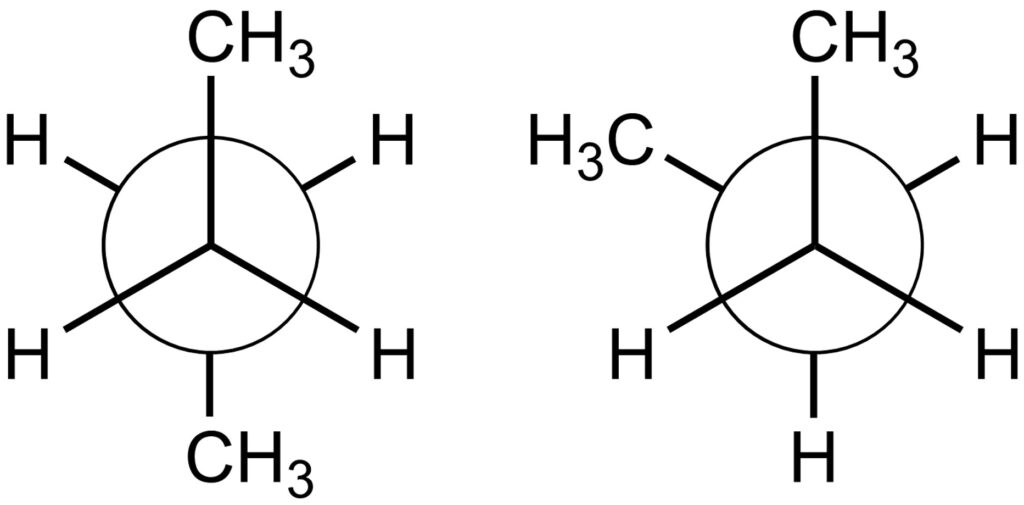
この時、左側のように置換基が180°離れた構造をアンチ形配座、右側のように置換基が60°離れた構造をゴーシュ形配座といいます。通常、ゴーシュ形配座よりもアンチ形配座のほうが安定です。
cis-trans異性体
1,2-ジメチルシクロペンタンは二つの構造が考えられます。メチル基が両方同じ方向に伸びた構造と、それぞれ異なる方向に伸びた構造です。
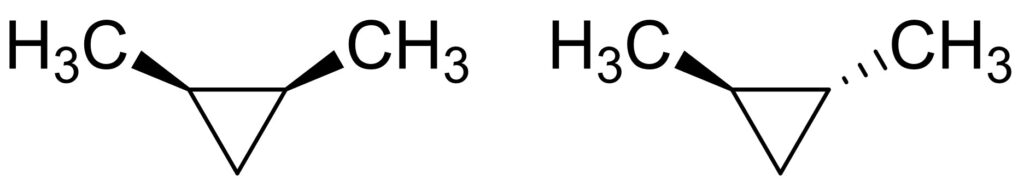
左側の構造のような、置換基が両方同じ方向に伸びた構造をシス体、右側の構造のような、置換基がそれぞれ異なる方向に伸びた構造をトランス体でといい、それぞれ、cis-1,2-ジメチルシクロペンタン、trans-1,2-ジメチルシクロペンタンと命名します。
シクロアルカンの環ひずみ
すべて単結合で結合している炭素はsp3混成軌道をなしていて、結合角は約109.45 °ですが、構造によっては多少歪みます。例えば、シクロプロパン環の結合角は60°です。
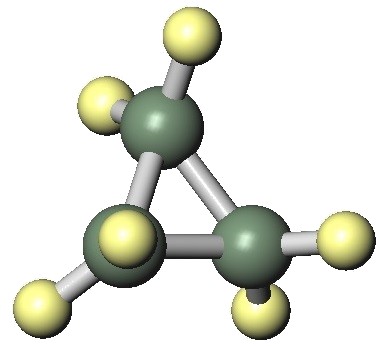
環構造は無限に考えられますが、その中で最も結合角が109.45°に近いのが、シクロヘキサンです。

左側の配座をいす形配座、右側の配座を舟形配座といいます。それぞれいすや舟に似た形になっています。
いす形配座のモデルは以下の通りです。

舟形配座のモデルは以下の通りです。
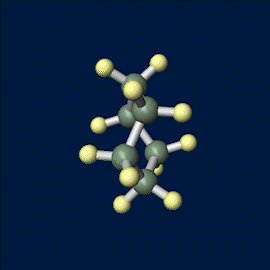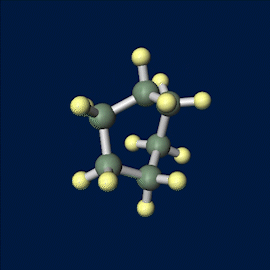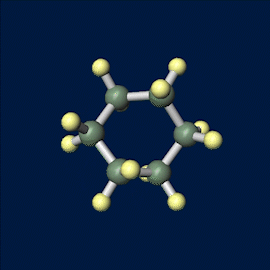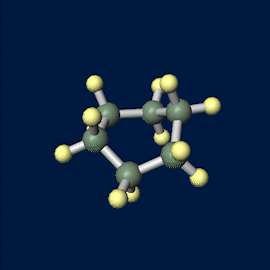
シクロヘキサンの立体配座は2つ存在しますが、いす形配座のほうが安定です。
これは、舟形のほうが重なり形の相互作用が多いことと、重なり形を解消しようとしてもそれが原因で水素原子同士が近づき不安定になるためです。
次に、いす形配座のNewman投影式を見てみましょう。
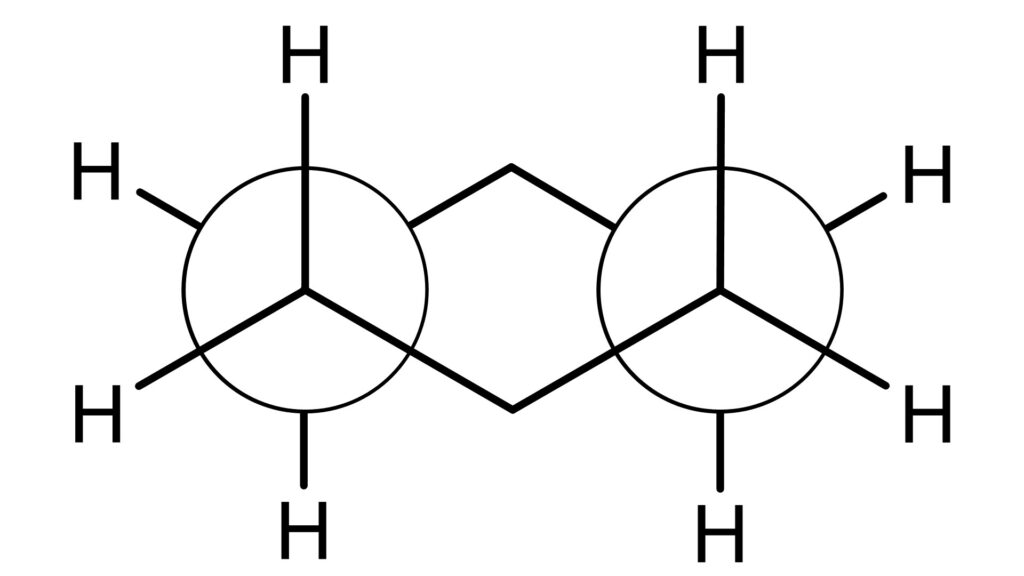
大きな丸で描かれた炭素の裏にはもう一つ炭素があります。
これを見ると、ゴーシュ形配座になっているように見えますが、いわゆるゴーシュ型のときに斥力が働く2つの水素は炭素になっているので、ひずみは生じません。
シクロヘキサンの立体配座
シクロヘキサンの立体配座についてもう少し詳しくみていきましょう。
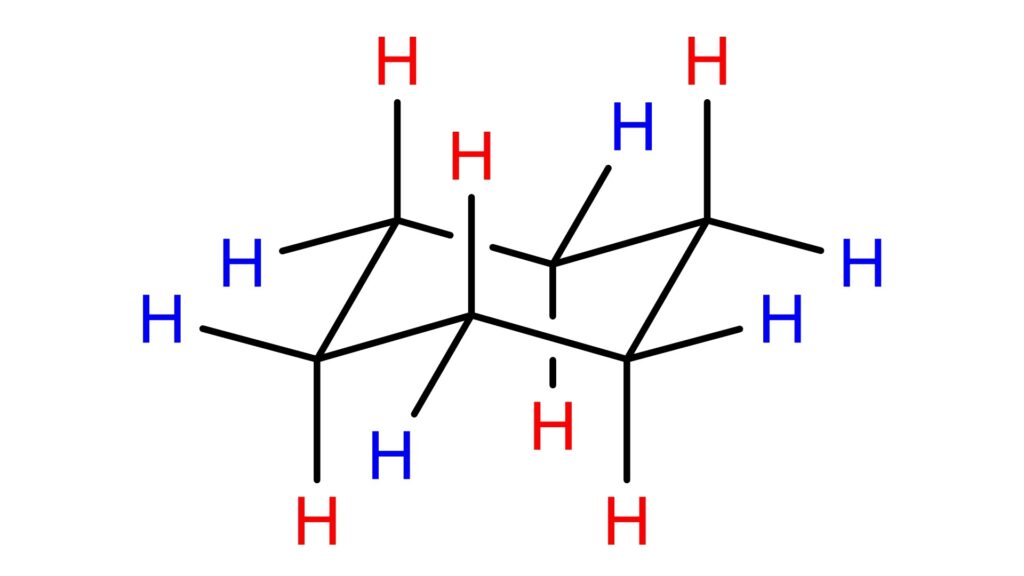
図10を見ると、鉛直方向を向いている水素と、横を向いている水素に分けられることが分かります。
鉛直方向を向いている水素が結合している位置をアキシャル(axial)位、横を向いている水素が結合している位置をエクアトリアル(equatrial)位といいます。
シクロヘキサンのアキシャル位に注目すると、アキシャル位には上下それぞれ3つずつ水素原子があり、これらは近接しています。
もし、このうちの一つがメチル基になったら、どうなるでしょうか。
メチル基の炭素から伸びる水素とアキシャル位の水素が非常に接近します。
そのため、ひずみエネルギーが生じます。また、これがもっと大きな置換基になるとそのひずみは更に大きくなります。
このような相互作用を1,3-ジアキシャル相互作用といいます。
ちなみに、メチル基の水素とアキシャル位の水素の間に生じるひずみは、ゴーシュ型配座のそれに他なりません。
ここで、アキシャル位にメチル基があるメチルシクロヘキサンについて考えます。アキシャル位においてメチル基と水素原子2つが隣接しているため、不安定な状態です。
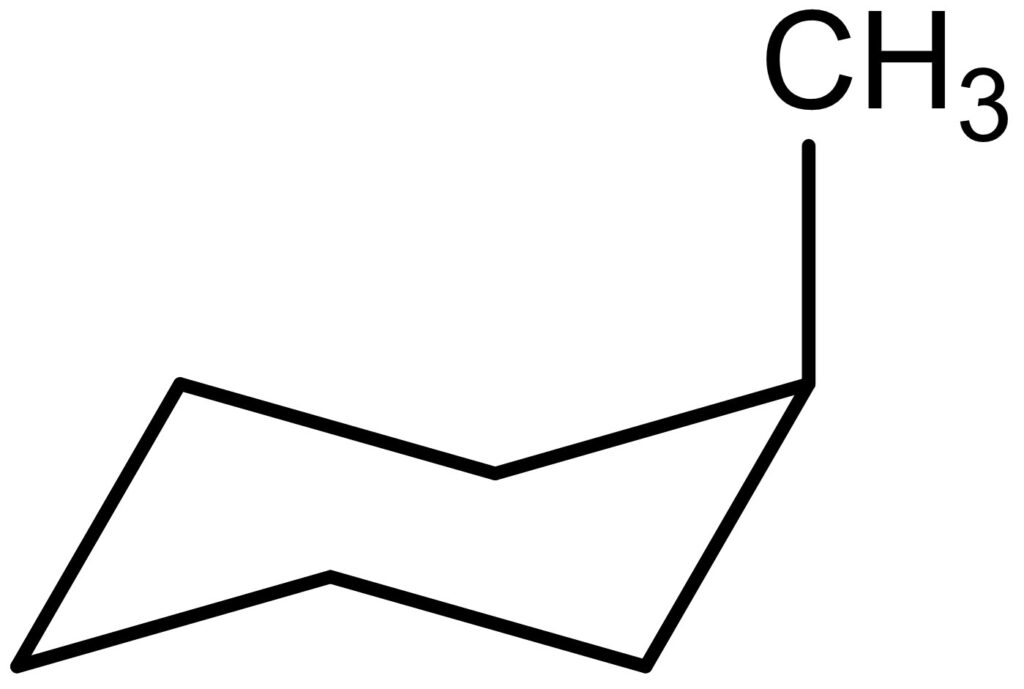
これを解消するために、シクロヘキサンは環反転します。シクロヘキサンにおける環反転は、いす形配座において背もたれの部分を下に動かし、脚の部分を背もたれになるように上へ動かします。

では、なぜ環反転が起こるとメチル基の1,3-ジアキシャル相互作用がなくなるのでしょうか。それは、環反転によってアキシャル位とエクアトリアル位が逆転するからです。
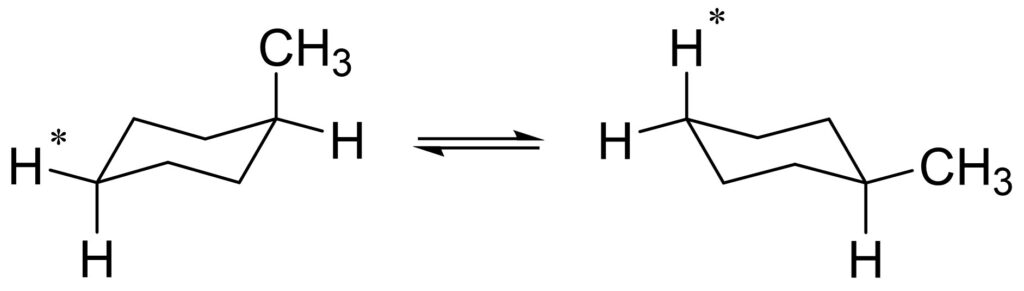
図13を見ると、確かにアキシャル位とエクアトリアル位が逆転していることがわかります。
これによって、メチル基は相互作用の小さなエクアトリアル位に移動し、より安定になります。また、参考までに、1つの水素をアスタリスクでマーキングして環反転させました。
常温において、シクロヘキサンは容易に環反転します。そのため、不安定な構造をとったら直ちに環反転して安定な構造をとります。すなわち、異性体は事実上存在しません。
さいごに
有機化学ではひずみの考え方が重要で、これによって反応性や生成物が変わってきます。
また、異性体も大切な概念です。
例えば、ある構造は薬として機能する一方、異性体では毒になってしまうということがあります。
サリドマイドという薬は有名な例で、異性体によって悲惨な事件が起きてしまったことがあります。興味があれば、「サリドマイド事件」で調べてみてください。
