化学が対象とする物質の概要を学びましょう。
元素: 万物の根源
万物の根源は何か。昔の哲学者たちは奮って探していました。
ガソリンは原油からできていて、原油は生物の死骸からできていて、生物は…というように深掘りしていくと、いずれは万物の根源にたどり着きそうな気がします。
この万物の根源の中でも、それ以上分割できないものを元素と呼んでいたとされています。
現代では、物質は原子と呼ばれる最小単位(注)からできていると広く(科学的に)信じられています。この記事を書いている時点で、118個の原子が知られています。
ちなみに、現代では実際に原子が見える顕微鏡が存在します。
注を表示
本当は、原子は最小単位ではありません。原子はさらに分割され、陽子と中性子に、またこれらはアップクォークとダウンクォークから構成されています。この二つのクォークは本当の最小単位とされています。
物質を構成する真の最小単位は、素粒子と呼ばれています。
素粒子についてはわからないことだらけです。素粒子は標準理論や超弦理論とよばれるとても難しい物理学(モデル)で説明されます。
周期表にはその118個の元素がすべて並べられています。
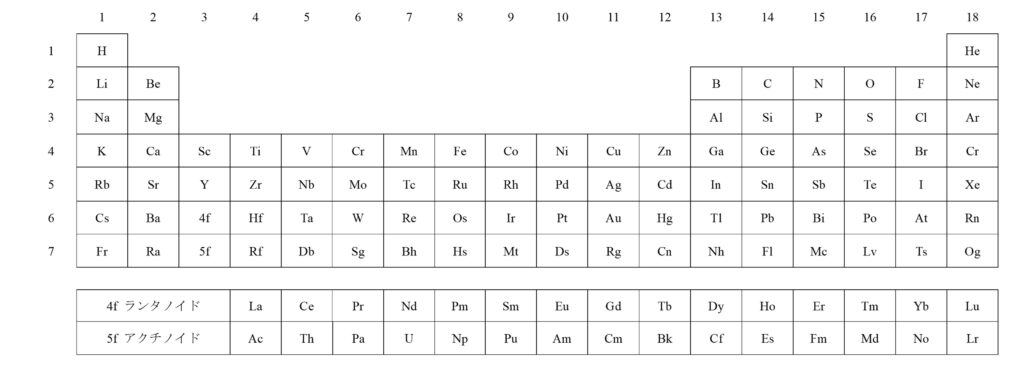
第n列(左からn番目の縦の並び)の元素を第n族元素、第n行(上からn番目の横の並び)の元素を第n周期元素といいます。
第二周期以降(水素以外)の第1族元素をアルカリ金属、第2族元素をアルカリ土類金属、第17族元素をハロゲン、第18族元素を貴ガスといいます。
第3から12族までの元素を遷移元素、それ以外を典型元素といいます。
周期表は元素をただ並べただけではなく、適切に並べた表です。この並びがなぜ適切なのかは、もう少し化学を学ぶとわかります。
周期表はインターネットで調べればいくらでも出てきますし、初等的な化学(一般化学)の教科書の表紙見返しにはほぼ必ず載っています。
おすすめは、(見やすさを考えなければ)文部科学省が発行している「一家に一枚」シリーズの周期表です。どの元素がどのように応用されているのかがわかります。
ということで、元素は原子であったというのが現代の解釈です。
なお、今では両者は互いに少し異なる意味で使われます。
原子は、物質を構成する最小単位で、具体的な実体を指し、
元素は原子の性質で分類する抽象度の高い概念です。
例えば、水素と呼ばれる原子Hが二つと酸素と呼ばれる原子Oが一つからなるH2Oという物質は、3つの原子(H, H, O)から構成されています。一方、元素という言葉を使って表現すると、2つの元素(H, O)から構成されているといえます。
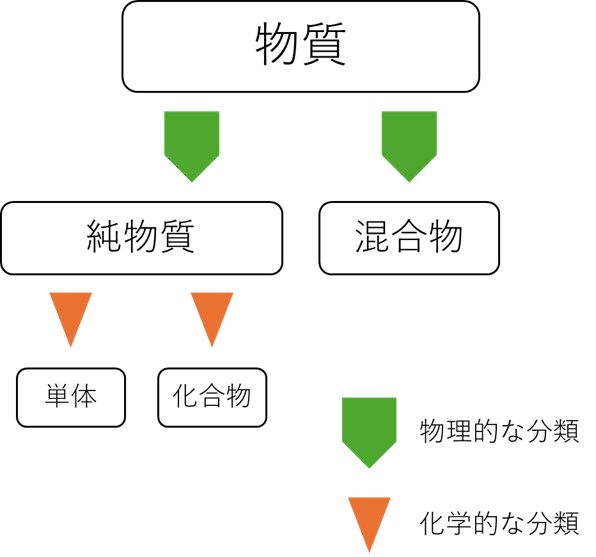
物質の分類
物質には二つの分類方法があります。物理的性質と化学的性質による分類です。
物理的とは、物質そのものと組成を変えずに観測できる様を表します。
化学的とは、物質そのもの又は組成の変化に基づく様を意味します。
例えば、H2Oという物質は0 °C以下だとカチカチ(氷)になり、常温だと流動性が生まれ(水)、100 °C以上だと空間を自由に動き回ります(水蒸気)。一般に多くの物質において、物理的変化によって固体、液体、気体の3種類に変化できます。この際、H2OがH3Oになるといった組成の変化(かつ物質そのものの変化)もなく、H2OがH2とOに分かれるといった物質そのものの変化も起きていません。また、H2O原子の並び順も変わっていません。
水H2OはH-O-Hという順番に原子が並んでいます。これがO-H-Hと変化した場合、この変化は化学的な変化(化学変化、化学反応という)です。H-O-HとO-H-Hは互いに化学的性質が異なると表現します(物質そのものの変化だが組成は変わらない)。H-O-HとO-H-Hは相異なる物質です。
さらに、水素H2が酸素O2の存在下で燃焼し、水H2Oを生成する反応は水素の化学的性質です(物質そのものの変化)。
これから先、物理的や化学的という言葉を頻繁に耳にすると思います。その際はこれらを思い出してください。
純物質と混合物(物理的な分類)
物理的性質によって、物質を純物質と混合物に分けます。
純物質は、単一の組成からなる物質です。純物質のことを単に物質という場合があります。
混合物は、複数の純物質が各々の物理的性質を維持したまま集まった物質です。
例えば、酸素O2や窒素N2はそれぞれ純物質です。一方、空気は酸素や窒素、二酸化炭素などの混合物です。
また、混合物は均一混合物と不均一混合物の2種類に分けられます。
水とエタノールを混ぜると均一に混ざります。これは均一混合物の例です。
一方、水と油を混ぜて静置しておくと、最終的には水の上に油が浮かんできます。これは不均一混合物の例です。
単体と化合物(化学的な分類)
先ほど紹介した純物質について、今度は化学的性質の観点から少しだけ分類します。
単一の元素からなる純物質を単体といいます。例えば、水素H2、アルゴンAr、オゾンO3は単体です。
複数の元素からなる純物質を化合物といいます。例として、水H2OやエタノールC2H6Oなどがあげられます。
物理・化学的性質による物質の分類まとめ
物質の分類をわかりやすく図にしてまとめます。
原子の構造
原子は、原子核とそれを取り巻く原子から構成されています。
さらに、原子核は陽子と中性子の集合体です。
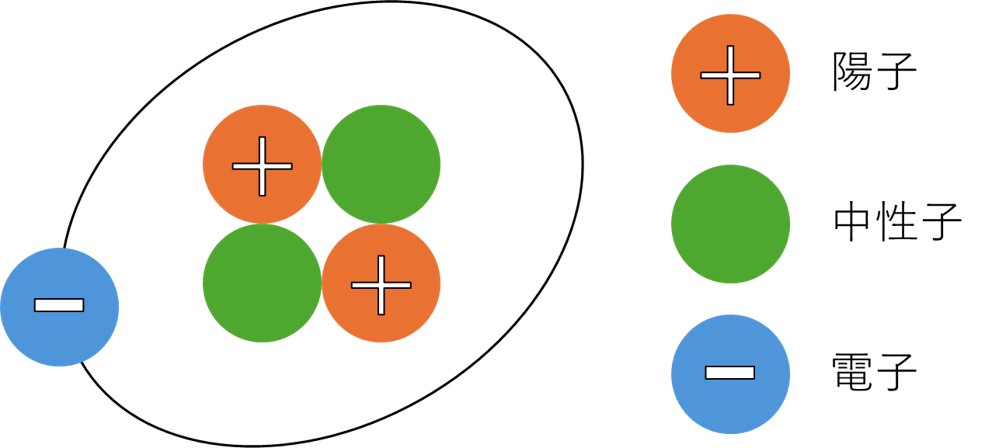
(注)ここでは電子が原子核の周りをまわっているように描きましたが、正確にはそうではありません。詳しくは当記事のレベルを超えるので割愛します。
電子は負電荷、陽子は正電荷を帯びていますが、中性子は電荷を帯びていません。
陽子の数を原子番号、陽子と中性子を合わせた数を核子数といいます。
元素は陽子の数、すなわち原子番号で区別されます。
1個の陽子からなる元素を水素、2個の陽子からなる元素をヘリウム…のような具合です。
周期表の右端以外にある元素の原子番号をnとすると、その右隣にある元素の原子番号はn+1です。
右端にある原子番号nの元素について、その直下の行の一番左に描かれている元素の原子番号がn+1です。
また、同一元素でも中性子の数が互いに異なるものを同位体と言います。
例えば、陽子1個の水素は、中性子が0, 1, 2個のものがあり、それぞれ水素、重水素、三重水素と呼ばれる同位体が存在します。
原子の大きさは、約10−10 m、すなわち1mを100億個に均等に分割したうちの一つ分と同じ長さです。
分子
ひとつの原子が孤立して存在するのは18族元素だけです。ほとんどの物質は2個以上の原子が繋がって存在します。このうち、電気的に中性かつ簡単には原子の繋がりが切れないものを分子といいます。
電気的に中性というのは、プラスでもマイナスでもないということです。
分子は、単体のものもあれば化合物もあります。例えば、水素分子H2は単体の分子で、水H2Oは化合物の分子です。
ここからは少し難しい話です。分子は2個以上の原子が繋がっていると説明しましたが、これらは具体的に何か物理的実体によって繋がっているわけではありません。ひもで結ばれて繋がっているわけでもなければ、セロハンテープで止められているわけでもありません。
これらは、共有結合と呼ばれる概念によって繋がっています。量子化学を学べばもう少し分子の対する見方が広がるのですが、この記事のレベルを優に超えるので、ここでは割愛します。
なお、単原子分子という言葉がありますが、これは厳密には分子ではありません。単原子なのに分子というのは変です。
先にも述べた通り、ほとんどの原子は単独で存在することはなく、分子として存在したがるります。そのため、貴ガスのような単原子で存在するものを原子と呼ぶのに抵抗があり、このような名前が生まれたのかもしれません。
ちなみに単原子分子は英語でmonoatomic gas、直訳すれば単原子気体です。分子(molecule)という単語は出てきません。
イオン
正または負の電荷を帯びている原子や分子をイオンと言います。
いやいや、分子は中性なのでは?と思われた方もいるでしょう。その通りなのですが、分子に電荷を帯びた原子や電子などがくっついて、全体として電荷を帯びる場合があるのです。
このようなものを分子イオンと呼ぶことがあります。
基本的に、イオンは正だけ、または負だけでは存在しません。例外なく正と負が互いに近くにいます(電気的中性の原理)。
例えば、塩として私たちも食べている塩化ナトリウムNaClは、正の電荷を帯びたナトリウムイオンNa+と負の電荷を帯びた塩化物イオンCl−がペアとして存在するイオン化合物です。
このように、正電荷と負電荷の相互作用(クーロン力)による結合を、イオン結合と言います。
なお、正と負を分けることは原理的には可能ですが、とてつもないエネルギーが必要になります。
