大学化学を勉強し、多くの方がはじめにつまづくのはs軌道やp軌道といった概念ではないかと思います。
当記事では副殻(s, p, d軌道など)について、簡潔にわかりやすく説明します。
量子力学と科学の発展
電子は原子核の周りを回っていると中学や高校で教えられた方もいるかと思います。
これはボーアモデルと呼ばれる原子模型(原子構成の仮説)を基にした考え方です。詳しくはこちらの記事で解説していますので、ぜひご覧ください。
しかし、実際はそうではありません。
量子力学によれば、電子の位置を正確に特定することはできません。このエリアにいる確率は何パーセントというように、確率としてしか分かりません。
位置が正確には分からないというのは、現代の科学の力ではわからないという意味ではありません。
科学者がどれだけ頑張って努力しても、本質的に分からないようになっているという意味です。
しかし、高確率で電子が存在する領域は分かります。このような領域を軌道や電子雲軌道や原子軌道、電子軌道、電子雲といいます(厳密には、軌道は電子の確率を数学的に表現した「波動関数」と呼ばれる関数のことを指しますが、便宜上上記の領域を軌道と呼ぶことが多いです)。
量子数
量子力学を用いて電子の位置について計算を進めると、次の3つの数が自然と出てきます。そしてそこに加えてもう1つの数を加えた計4つが重要になります。
- 主量子数(\(n\))
- 方位量子数(\(l\))
- 磁気量子数(\(m\))
- スピン量子数(\(m_s\))
具体的な計算はかなり煩雑なので割愛します。物理化学を勉強するとどこかで計算することになると思います。
主量子数は電子の空間的な広がりやエネルギーの大きさを表します。とり得る値は\(n=1,2,3, \cdots\)です。ボーアモデルで出てきた\(n\)は、実は主量子数でした。
方位量子数は、電子のいる場所の形(電子軌道又は単に軌道という、原子の場合は原子軌道といい、分子の場合は分子軌道という)を決めます。とり得る値は\(l=0, 1, \cdots, l-1\)です。\(l=0\)の軌道をs軌道、\(l=1\)の軌道をp軌道、\(l=2\)の軌道をd軌道、\(l=4\)の軌道をf軌道といいます。
磁気量子数は、軌道の向きを表します。とり得る値は\(m=-l, -l+1, \cdots, -1, 0, 1, \cdots, l-1, l\)、つまり\(-l\)から\(l\)までの\(2l+1\)個の整数です。
スピン量子数は\(m_s = +\frac{1}{2}, -\frac{1}{2}\)をとり得る値としてもつ数です。詳しくは知らなくてもいいと思いますし、前提知識がないと難しい話になるので割愛します。
電子軌道の数はスピン量子数以外で決まります。例えば、任意の\(n\)についてs軌道(\(l=0\))は\(m=0\)の1つだけをとるため、s軌道の数は1つです。p軌道(\(l=1\))は\(m=-1, 0, 1\)の3つをとるため、p軌道の数は3つです。同様にして、d軌道は5つ、f軌道は7つあります。
また、\(n=1\)ではs軌道だけしかないことは方位量子数の取り方が\(l=0\)しかないことから分かります。p軌道が出てくるのは\(n\ge 2\)で、d軌道が出てくるのは\(n\ge 3\)からであるということも大切です。
加えて、\(m\)の値によって軌道の向きが違います。s軌道は球状で向きはありませんが、p軌道はそれぞれx, y, z軸方向を向いた軌道があります。
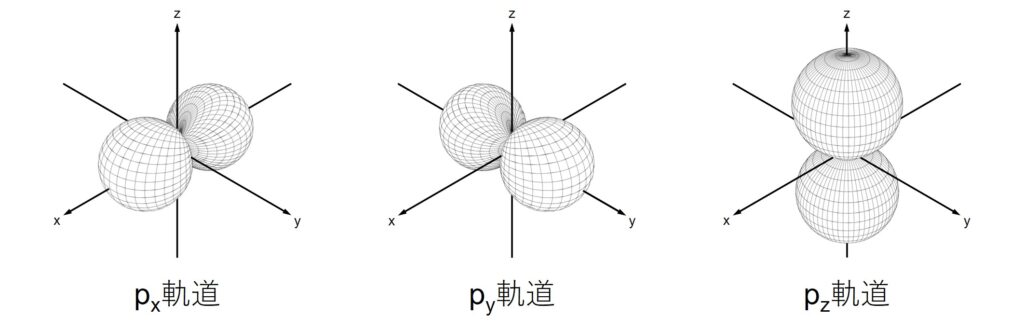
s, p軌道の形と名前は覚えましょう。(化学を学習していれば嫌でも覚えてしまうと思いますが。)
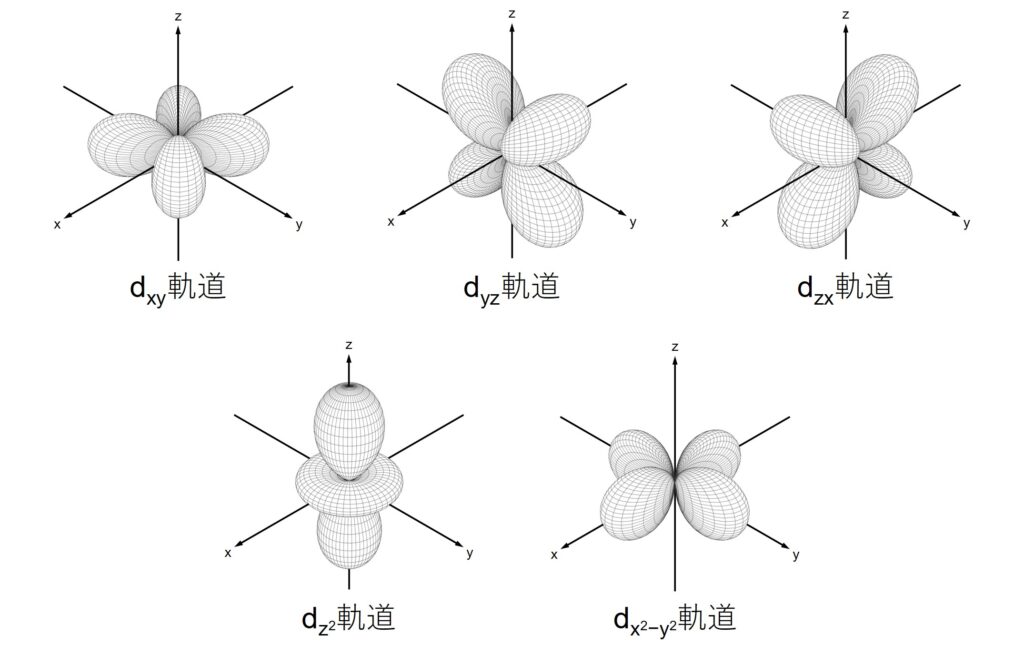
d軌道も覚えるべきですが、s, p軌道に比べれば優先順位は低めです。図3のうち、上の3つは電子が軸上に存在せず、下の2つは軸上に存在します。
この事実は錯体化学で重要な役割を果たしています。f軌道は使う機会があまりないため、興味があれば見てみる程度でいいと思います。
このような、s, p, d, f, …軌道のことを副殻といいます。
また、\(m\)がもっと大きくなればg軌道、h軌道といった具合にf軌道以降はアルファベット順で名前がつくのですが、これらが教科書で出てくることはまずありません。
加えて、図の1から3に描いた軌道は角度成分を描いているだけで、動径方向については何もわかりません。
一般化学ではそこまで深入りする必要はないため、動径成分と角度成分については説明しませんが、詳しいことは量子化学を学べばわかります。
最後にスピン量子数です。とり得る値が2つあることから1つの軌道に最大2つまで電子が入ることがわかるのですが、詳しいことは気にしなくても大丈夫です。「1つの軌道には電子が2つまで入る」ということだけ覚えておいてください。
電子収容における3つのルール
原子は電子をもちます。その数は原子が持つ陽子数と同じです。また、電子がどこにいるかは確率で決まり、その領域には特定の形がある、というのが先ほど説明した内容です。
では、各々の電子はどのような形の軌道にいるのでしょうか。これは、次の3つのルールによって決まります。
- 構成原理
電子はエネルギー準位の低い軌道から入っていく。 - パウリの排他原理
軌道には最大2つの電子を収容できるが、それらのスピンが逆向きでなければならない。 - フントの規則
エネルギー準位の等しい軌道が複数ある場合、できるだけ均等に、スピンをそろえて電子が入る。
分からない単語があったかもしれませんが、これから丁寧に解説します。
マーデルングは、主量子数\(n\)と方位量子数\(l\)の和\(n+l\)が大きいほど軌道のエネルギー準位が大きく、和が等しいもの同士に関しては主量子数の大きい軌道のほうがよりエネルギー順位が大きいというマーデルングの規則を見出しました。
構成原理とマーデルングの規則によると、電子は次の図1に示すような順番で入ることがわかります。
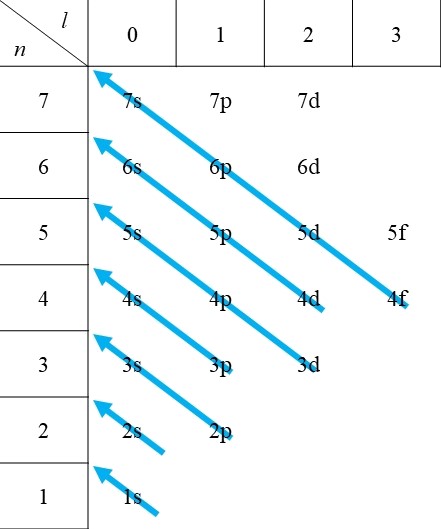
マーデルングの規則の文章的説明を覚えるというよりは、図1をご自身で描けるようにすることをお勧めします。
基本的にはこれに従って電子を入れていけばいいわけです。一部の軌道のエネルギー準位を図にすると次の通りです。
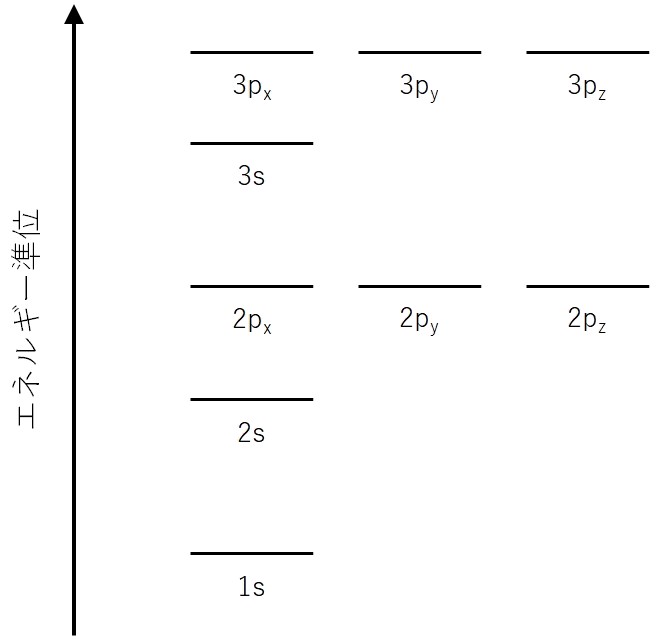
ここに電子を入れていきます。例えば、水素原子は陽子を1つ持つので電子も1つ持ちます。構成原理から、1s軌道に電子が1つ入ります。
次に、ヘリウムについて考えます。ヘリウムは電子を2つ持ちます。構成原理とパウリの排他原理より、今度は2つの電子が逆向きのスピンをもって入っていきます。
スピンとは何かを理解するのは、量子力学を学んでいないと難しいです。初めのうちは、球体が回る向きが時計回りと反時計回りの二つがあるように、電子の回る向きにも2つ存在するのだと思っておけば良いと思います。
(実際、歴史的にはそのように解釈されてきました。しかし、実際のところはスピンに対応する古典的な物理量が存在しないため、非常に分かりにくい概念となっているのです。)
電子のスピンは矢印を用いて表します。スピンにはアップスピン(αスピン)とダウンスピン(βスピン)がありますが、アップスピンを上向き矢印↑、ダウンスピンを下向き矢印↓で表します。
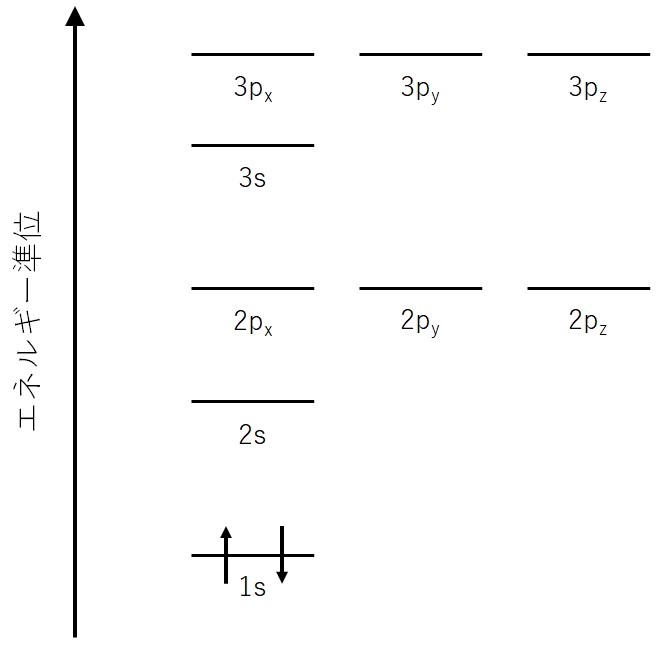
なお、アップやダウンという言葉は、上や下を向いているという意味ではありません。深いことは気にせず、相異なる二つの状態があるのだと思ってください。
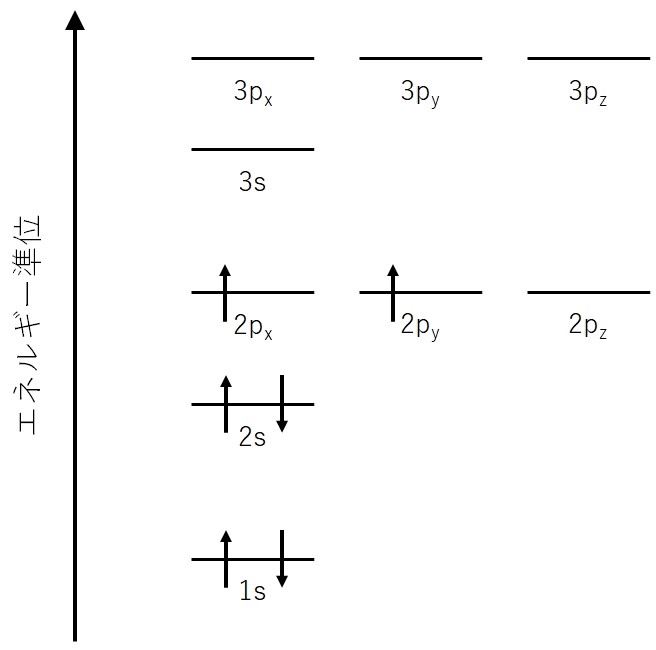
炭素について見ていきましょう。炭素は電子を6つ持ちます。1s, 2s軌道と電子を4つ入れ、5個目を2pxに入れることにしましょう。
pxから入るという規則はないのですが、ひとまずpx軌道に入るということにします。次に、6個目の電子はフントの規則にしたがって、同じエネルギー準位で別のp軌道に、スピンをそろえて入ります。
今回は、アップスピンで2py軌道に電子が入っているとしましょう。ここでも、2pyに入るというルールはなく、2pzに入っても問題ありません。
酸素について見ていきましょう。酸素は電子を8つ持ちます。1s, 2s軌道を埋めるのに4つの電子を入れ、2p軌道にフントの規則を満たすように電子を3つ入れます。
最後の1つは構成原理とパウリの排他原理にしたがって、逆向きのスピンで2p軌道のどれかに入れれば完成です。
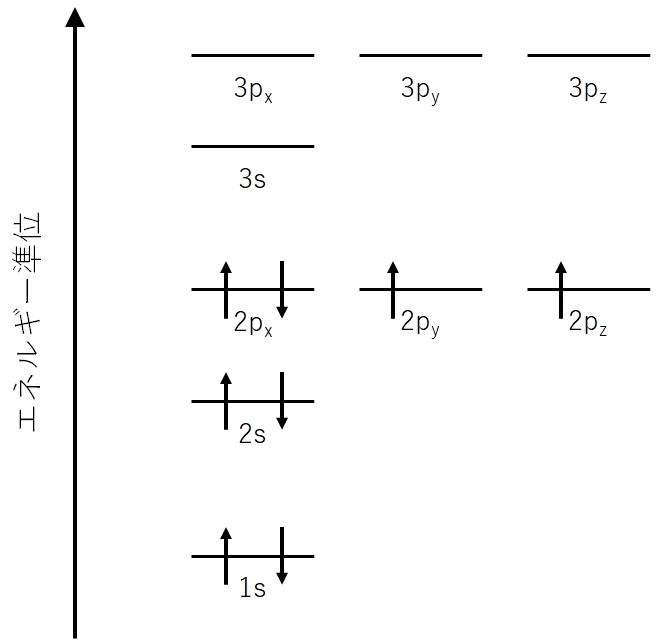
なお、水素原子はこれらのようなエネルギー準位にはならず、同じ主量子数の軌道はすべて同じエネルギー準位になります。
もうひとつの例として、ナトリウムNaの電子配置を考えてみましょう。
Naの原子番号は11番ですから、エネルギー準位の低い軌道から順に11個の電子を入れていくと、1sに2個、2sに2個、2pに6個、3sに1個となります。
ここで、電子配置の書き方を紹介します。Naの電子配置は次のうちどちらかのように表記します。
1s22s22p63s1
[Ne]3s1
上段は、軌道の名称の右上にその軌道にある電子の数を表記する書き方です。一般的には主量子数の小さい軌道から、s, p d, f軌道の順に書きます。
下段は、1s22s22p6の部分がネオンNeの閉殻構造になっているため、[Ne]と表記して、それに続けてそれ以降の電子配置を記述する方法です。
他の原子に関しても、貴ガスの閉殻構造をもっている場合はこのような書き方をします。当サイトでは後者の書き方を採用します。
また、原子から電子が取れて陽イオンになる場合、エネルギー準位の高い軌道にある電子から順に抜けていきます。
さらに、電子を得て陰イオンになるときは空席がある軌道のうちエネルギー準位の最も低いものから順に入っていきます。
マーデルングの規則において、注目すべきは3d軌道と4s軌道です。エネルギー準位の大きさが1s, 2s, 2pとくれば、3s, 3p, 3d, 4sとなりそうなのですが、実は3d軌道の方が4s軌道よりもエネルギー準位がわずかに高いのです。
初めは混乱してしまうかもしれませんが、そのうち慣れてくると思います。また、この小さなエネルギー差が、次に紹介する電子収容の例外を生み出すのです。
電子収容の例外
マーデルングの規則を使うことで各原子の電子配置がわかるわけですが、第5周期以降では例外が多くなってしまいます。
そのため、マーデルングの規則が使えるのは第4周期あたりまでです(とはいえ普通は分光学的な測定で多くの原子の電子配置が既に調べられているのですが)。
第4周期での例外はクロムCrと銅Cuの2つで見られます。まずCrの電子配置を考えましょう。Crの原子番号は24なので、1sから順に24個の電子を入れていきます。
19, 20個目を4sに二つ入れると、次は3d軌道に4つ電子を入れ、電子配置を[Ar]3d44s2と書きたいところなのですが、実際の電子配置は[Ar]3d54s1なのです。
これは、d軌道に電子が半分埋まった状態のほうがより安定だからです。なぜ安定かという話は少し難しく、交換相互作用などによるものと考えられていますが、詳しい話は当記事のレベルを超えるため、割愛します。
なお、交換相互作用による安定化はそこまで大きくなく、3d軌道と4s軌道のエネルギー差が大きく開いていれば、このようなことにはならなかった、ということも付け加えておきます。
似たようなことがCuでも起こります。先ほどと同様にCuの電子配置を考えると[Ar]3d94s2としたいところなのですが、実際は[Ar]3d104s1であることが知られています。
今回は、3d軌道を閉殻にした方が安定になるからこのようなことが起こるのですが、この話も割愛します。
とても簡単に申し上げると、この世の中は対称性を好む傾向にあり、対称性を保とうとするような法則がたくさんあります。
3d軌道に電子が5個、あるいは10個ある方が見た目はきれいなため、例外的な電子配置をとります。一応このような理屈を付け加えておきますが、第4周期での例外はCrとCuだけなので、覚えてしまうほうがいいと思います。
また、第5周期になるとさらに例外が多くなりますが、それらを覚える必要はありません。周期表の下にある元素ほど埋蔵量が少なくなってくるため、使う機会が少ないからです。研究等でそのような元素を使う機会が訪れたときに電子配置を調べれば十分でしょう。
もう一つ重要なことがあります。それは、3d金属(ScからZnまでの元素)のイオン化、特に陽イオンになった時の電子配置です。
原子から電子が抜けるとき、一番エネルギー順位の高い軌道から抜けていくのが普通です。
しかし、3d軌道と4s軌道のエネルギー差が小さいことから、最外殻の4s軌道から抜けていくことが知られています。
例えば、Tiの電子配置が[Ar]3d24s2なため、Ti2+の電子配置は[Ar]3d2です。
